- Входной контроль качества лекарств (общая характеристика, терминология, количественный анализ)
- Терминология
- Процедура, методика проведения входного контроля качества лекарства
- Литература по входному контролю
- Полезно знать
- Последовательность входного контроля
- Разработка стратегии контроля качества продукции – современный подход «Большой Фармы»
Входной контроль качества лекарств (общая характеристика, терминология, количественный анализ)
Терминология
Входной контроль качества — контроль качества лекарств, действующих и вспомогательных веществ (при их получении субъектом хозяйствования), который осуществляется путем визуальной проверки или анализа. Входной контроль осуществляет уполномоченное лицо, назначаемое приказом руководителя субъекта, ответственное за качество и количественный анализ лекарственных средств, поступающих в аптеку.
Процедура, методика проведения входного контроля качества лекарства
Уполномоченное лицо проводит визуальный контроль и проверяет соответствие полученных АФИ сопроводительным документам по количеству, дозировка, номеров серий, сроков годности, регистрационного статуса, наименования, названия производителя и лекарственной формы. Каждая серия действующих веществ должна сопровождаться сертификатом качества, который выдается производителем.
В случае хранения сертификатов качества в виде сканированных копий поставщик обязан предоставить его бумажную копию, заверенную печатью (по запросу), в срок не позднее 2 дней. Дополнительно с сертификатом анализа на соответствие показателей качества требованиям АНД должны сопровождаться действующие вещества, используемые в аптеках для изготовления и количественного анализа лекарственных средств по экстемпоральной рецептуре (по выборочным показателям), АФИ, используемых в аптеках для изготовления парентеральных и офтальмологических лекарств (по всем показателям АНД) , препаратов наркотического, психотропного действия и прекурсоров, ЛП для наркоза (за исключением кислорода и азота), рентгеноконтрастных, противотуберкулезных препаратов, содержащих рифампицин, изониазид, эт мбутол, пиразинамид. После проверки входного контроля качества и соответствия полученных лекарств и фармацевтических субстанций сопроводительным документам переходят к осуществлению визуального контроля, то есть к проверке состояния групповой тары, наружной (вторичной) и внутренней (первичной) упаковки, маркировки, наличия листа-вкладыша доступной для потребителя языке (если эта информация не нанесена на вторичной упаковке), срока их годности. При возникновении сомнений в качестве и количественному анализу лекарственных средств или АФИ проверяют (с раскрытием упаковок) размеры, форму, цвет, однородность, количество единиц в упаковке, наличие загрязнений.
Литература по входному контролю
- Приказ МЗ Украины № 436 от 30 октября 2001 «Об утверждении Инструкции о порядке контроля качества лекарственных средств оптовой и розничной торговли».
^Наверх
Полезно знать
© VetConsult+, 2015. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
Источник
Последовательность входного контроля
Входной контроль сырья и материалов.
Контроль качества на химико-фармацевтическом предприятии.
Служба контроля качества на химико-фармацевтическом предприятии
Контроль качества лекарственных средств.
Контроль качества — это часть «Правил GMP», включающая отбор проб, проведение испытаний, выдачу соответствующих документов, гарантирующих, что все необходимые испытания действительно проведены, процесс производства соответствовал требованиям регламентов, а готовый продукт был реализован только в том случае, если его качество отвечало требованиям НД.
Лекарственные средства, серийно выпускаемые промышленными предприятиями подвергаются следующим видам контроля:
— внутризаводскому, который подразделяется на входной, контроль в процессе производства и приемо-сдаточный (контроль готовой продукции);
Внутризаводской контроль осуществляется службой контроля качества предприятия.
Для этого в структуре каждого фармацевтического предприятия обычно существуют соответствующие отделы: это или отдел контроля качества (ОКК) или отдел технического контроля (ОТК). Это самостоятельное и независимое структурное подразделение, которое возглавляется квалифицированным специалистом и руководствуется в своей работе государственными и отраслевыми документами, регламентирующими его деятельность.
Структура ОТК зависит от объема и характера производства. Обычно она включает несколько лабораторий: аналитическую, биологическую, бактериологическую и др. В них имеются отдельные группы:
— контроля в процессе производства;
— контроля готовой продукцией.
В функции ОТК входят:
1. Контроль качества изготовляемой продукции и поставляемого сырья в соответствии с требованиями нормативной документации, (ГФУ, ФС, ГОСТов, ТУ, стандартов предприятия).
2. Систематическая проверка выполнения предприятием приказов, инструкций и указаний Министерства здравоохранения.
3. Технический учет и анализ причин брака, изучение причин брака, участие в разработке мероприятий по ликвидации брака;
4. Контроль за упаковкой готовой продукции;
5. Составление паспортов или иных документов, удостоверяющих качество выпускаемой продукции;
Каждая серия сырья и материалов, поступающих на предприятие, подлежат обязательному контролю ОТК.. Для этого лаборант ОТК отбирает соответствующие пробы, порядок отбора и количество определены соответствующими инструкциями.
Основное сырье – сырье, которое входит непосредственно в лекарственную форму анализируется согласно всему перечню показателей, описанных в АНД. Вспомогательное сырье и материалы допускается анализировать только по тем показателям качества, которые могут повлияют на качество готового ЛП.
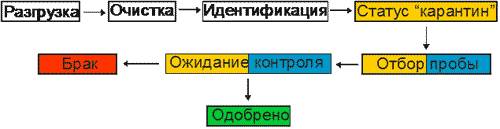
Отбор проб сырья и материалов производится непосредственно на складе в специально оборудованном помещении. Чтобы избежать перемешивания используют соответствующую логистическую цветную маркировку.
1. Поступивший продукт на первом этапе маркируется белой идентификационной (информационной) этикеткой.
2. Затем контролер ОКК осуществляется процедуру приемки. На упаковку клеится этикетка желтого цвета, что означает ожидание отбора пробы (статус карантинного хранения).
Содержание желтой этикетки:
— контрольный номер ОКК
3. Следующий этап — отбор проб сотрудником ОКК в присутствии работника склада. в специально отведенной зоне, предотвращающей возможность контаминации образцов и продукции. Отобранные образцы опечатываются либо пломбируются и снабжают этикетками, подписанными лицами, участвующими в отборе. Вскрытая тара запечатывается, а на место вскрытия помещается голубая этикетка. Содержание голубой этикетки:
— количество отобранной продукции
— ФИО контролера ОКК, отобравшего продукцию
— дата отбора пробы
— подпись контролера ОКК
Об отборе образцов (проб) составляется акт, подписываемый сотрудником ОКК и работником склада.
4. При положительных результатах анализа продукта, сотрудник ОКК оформляет разрешение на применение и заменяет желтую этикетку зеленой, а продукция переводится из зоны приемки в зону хранения, из которой может быть выдан в производство.
Содержание зеленой этикетки:
— контрольный номер ОКК
— номер разрешения на применение
— подпись контролера ОКК
5. При отрицательных результатах анализа, сотрудник ОКК составляет акт о забракованной продукции и заменяет желтую этикетку красной, а продукция переводится в зону брака. где она находится до решения вопроса о дальнейшем использовании. Продукт быть выдан только по специальному разрешению ОКК или отправлен на утилизацию или возвращен производителю.
Таким образом, соблюдается один из главных принципов GMP — обеспечение последовательности продвижения материалов и продуктов в технологическом процессе. Процесс выстроен по следующей логистической цепочке (схеме):
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Разработка стратегии контроля качества продукции – современный подход «Большой Фармы»
Тезисы доклада для Алматинского Форума Качества, 6-8 Октября 2011 года
Доклад посвящен новым подходам фармацевтических компаний, лидеров фармацевтического рынка США И ЕС, к организации входного, межоперационного и приемочного контроля качества лекарств. Подход основан на использовании многофакторного планирования экспериментов, управлении рисками еще на стадии разработки продукта, на статистическом управлении процессами и выпуске по параметрам (т.е. принятие решения о качестве не на основании приемочного контроля выборки, а по значениям параметров оборудования)
Что такое «BigPharma»?
Термин «Большая Фарма» означает коллегиальное образование, в состав которого входят ведущие мировые производители в основном инновационных лекарств. К таким компаниям относятся Pfizer, Novartis, AstraZeneca, Merckи др. Большая фарма – это нечто больше, чем бизнес-модель, построенная на крупных рынках и доходах от блокбастеров. Менеджеры корпораций, входящих в Ассоциации производителей фармацевтической продукции США и Великобритании, считающихся ядром Большой Фармы, традиционно имеют огромное влияние на развитие законодательной базы в фармацевтической отрасли и тенденции ее мировой гармонизации. ИменнопредставителиPfizer, Merck&Co, Novartis, Bristol-MyersSquibbCo., EliLilly и др. гигантов входят в рабочие комитеты ICH, FDA, участвуют в совершенствовании законодательной базы Евросоюза, России, Казахстана и Украины.
Государственная политика всех без исключения стран СНГ декларирует принципы создания и развития эффективного отечественного фармацевтического производства. Но и цена входа новой компании на этот рынок продолжает расти. Уровень расходов на создание, государственную регистрацию и обеспечение выпуска коммерческих серий лекарственных средств настолько велик, что любые проблемы с качеством просто недопустимы, так как могут стоить компании всего ее будущего. Принимая ту или иную стратегию, каждая компания выбирает свой путь, но какой бы путь она не выбрала, качество (а это прежде всего эффективность, безопасность и соответствие лекарства заявленной спецификации) было и остается одним из основных факторов успешности фармацевтического бизнеса.
Очевидно, на этом фоне отечественным специалистам будет интересно оценить тенденции развития современной (или как ее уже величают, инновационной) стратегии качества выпускаемых лекарств, которую исповедуют лидеры мирового фармацевтического рынка.
Традиционный контроль качества
Отечественная система контроля качества лекарственных препаратов стоит на трех китах – входной контроль, межоперационный (или как часто называют, внутрипроизводственный) и приемочный контроль готовой продукции. Именно на этой модели работает 100% всех отечественных предприятий стран бывшего СССР.И традиционно, ответственность за поддержание такой системы полностью возложена на службу качества предприятия.
Входной контроль проводится для всех поступающих серий исходного сырья (активные субстанции и вспомогательные вещества). При этом объем входного контроля включает все без исключения показатели спецификации (ГОСТ, ОСТ, ТУ или внутренний норматив) независимо от назначения того или иного вещества в лекарственной форме препарата. Лабораторные испытания проводятся в аккредитованных государственных или аттестованных производственных лабораториях, зачастую дублируя друг друга. В соответствии с требованиями Приложения 8 GMP аналитический тест на подлинность проводится для каждого тарного места в серии сырья. На основании результатов лабораторного контроля Уполномоченное Лицо принимает решение о возможности использования каждой серии сырья в производстве.
Объем межоперационного контроля, как правило, определяется технологом, разрабатывающим технологическую документацию, согласовывается службой качества и руководителем производственного участка. Вопросы обеспечения репрезентативности пробы и условия ее транспортирования (хранения) зачастую остаются незамеченными. Основной акцент ставится на необходимости контроля максимально возможного числапараметров процесса и качества продуктов. При этом все решения, связанные с несоответствующей продукцией может принимать только Уполномоченное Лицо. Это связано с тем, что одним из ключевых принципов GMP декларируется независимость службы качества от службы производства.
Приемочный контроль осуществляется после окончания всех производственных операций. Такой контроль включает лабораторные испытания контрольных образцов, отобранных из предъявленной серии лекарственного препарата и оценку досье серии (подборка всех записей (протоколы, журналы), которые велись в ходе всего производственного процесса). Серия может быть выпущена на рынок (отправлена потребителю) только после письменного разрешения Уполномоченного Лица.
Такая организация контроля характеризуется отсутствием гибкости, избыточными испытаниями и большими потерями ресурсов. Однако по мнению большинства регуляторных органов стран бывшего СССР это с лихвой компенсируется качеством выпускаемой на отечественных предприятиях продукции.
Контроль качества, основанный на оценке риска
Одной из ярких тенденций последних лет является стремление увлечь специалистов фармацевтических предприятий в мир управления рисками. Этот мир позволяет упростить и уменьшить количество хаотичных движений, связанных с контролем без потери гарантий качества препарата. Большинство фармацевтических компаний уже пришли к пониманию того, что не все показатели качества и параметры процесса нужны и одинаково важны для получения убедительных доказательств качества выпускаемой продукции.
Современный подход, основанный на оценке рисков, заключается в том, чтобы на каждом этапе выбранной стратегии контроля (входной, межоперационный и приемочный контроль) обеспечивается контроль только критических параметров процесса и критических показателей качества продукта. Под критическим показателем качества продукта понимается физическое, химическое или биологическое свойство, выход которого за пределы установленной спецификации может привести к серьезным последствиям для потребителя. А под критическим параметром процесса понимается параметр, изменчивость (вариабельность) которого может привести к выходу критического параметра за пределы спецификации.
Другими словами, входной контроль проводится по тем показателям спецификации на сырье, которые важны для достижения качества готового продукта. Объем входного контроля (сплошной, выборочный) индивидуален, определяется степенью доверия к поставщику и основан на результатах аудита его производственной площадки. Межоперационный контроль также проводится только по показателям и параметрам, критичным для каждого отдельного продукта. При этом объем межоперационного контроля может быть значительно уменьшен по результатам валидации процессов и ежегодного обзора качества. Приемочный контроль частично (по отдельным показателям) основан на данных межоперационного контроля, частично на результатах лабораторного контроля контрольных образцов из серии. Процедура одобрения серии остается неизменной – серия может быть выпущена на рынок (отправлена потребителю) только после письменного разрешения Уполномоченного Лица на основании оценки досье серии и результатов аналитического контроля образцов готовой продукции.
В своем большинстве этот подход присущ современным фармацевтическим компаниям, которые стремятся работать на рынках различных стран. У отечественных производителей стран бывшего СССР развитие данного подхода ограничено. Во многом это вызвано двумя причинами. Первая – отсутствие достаточной компетентности у специалистов предприятий, и вторая, пожалуй основная, – «боязнь» регуляторных органов отпустить предприятия в свободное плавание, ослабить созданную и зацементированную десятилетиями систему тотального государственного контроля.
Инновационные подходы Большой Фармы
Фармацевтический рынок изменяется очень быстро. Инновационная компания тратит на разработку, исследования и регистрацию препарата в среднем около 1 млрд. долларов США. Все необходимые работы по внедрению нового продукта растягиваются на 10-15 лет. А срок патентной защиты у такого лекарства составляет 20 лет. Другими словами у производителя остается 5-10 лет на компенсацию всех своих затрат по препарату и получение «легкого» заработка. И понятно, что каждый час простоя, каждая минута решения вопроса о качестве сырья, полупродуктов и готовой продукции – это в среднем от 3000 до 20 000 долларов США. Учитывая все финансовые риски, мировые лидеры уже давно работают только с одобренными поставщиками, подтвердившими свою надежность безупречным партнёрством и качеством сырья. Мировые лидеры уже давно не допускают к самостоятельной работе необученных операторов. Цена ошибки такого оператора исчисляется миллионами, поэтому расходы в размере 2000-3000 долл. США на первичное и специальное обучение каждого новичка воспринимаются как желаемые предупреждающие затраты. Мировые лидеры уж давно работают на современном оборудовании, не экономя ресурсов на его обслуживание и замену. Именно поэтому традиционная ситуация с контролем качества уже давно не устраивает мировых лидеров. Тотальный входной контроль эффективен только при высокой доле брака в исходном сырье, выборочный межоперационный контроль – при слабых навыках операторов и плохом состоянии инфраструктуры (оборудование, инженерные системы и чистые помещения), а приемочный контроль на единичной выборке – по своей сути не информативен, ненадежен и неэффективен, если в ходе межоперационного контроля накапливается достаточный объем статистически обрабатываемых данных. Более того, полагаясь на тотальный контроль мы только ухудшаем ситуацию, делая фармацевтическое производство непрогнозируемым. Более того он не имеет смысла. Именно поэтому три кита нашего отечественного фармпрома, там у них за рубежом, рассматривается не как гарантия качества, а скорее как ограничение производственных возможностей и увеличение себестоимости и так не дешевых препаратов.
Понимая свою ответственность перед потребителем, принимая все возможные финансовые выгоды от использования современных знаний, инжиниринга и уровня развития компьютерной техники, мировые лидеры и ведущие регуляторные органы (ЕС, США),опираясь на существующие нормативные требования, на протяжении последних 2-х лет вводят новые концепции инновационного обеспечения качества при разработке, производстве и контроле качества ЛС.
В англоязычном пространстве эта концепция прочно закрепилась в документах ICHQ8, Q9, Q10 и Q11 под термином «Quality-by-Design, QbD». В русском языке специалистам еще придется найти подходящий термин. На сегодня есть два его наиболее широко употребляемыхварианта – «Качество через разработку» и «Спланированное качество». Смысл такой концепции заключается в том, что качество программируется (закладывается, создается) на этапе разработки препарата. Все последующие этапы жизненного цикла (перенос технологии, валидация процессов, производство и продажи) должны поддерживать выбранную стратегию контроля и уточнять (при необходимости изменять) ее с учетом объема накапливаемых данных и выявляемых тенденций.Более того,не успев закрепиться в умах специалистов концепция QbDнедавно получила свое развитие в виде процессно-аналитической технологии (ProcessAnalyticalTechnology, РАТ), позволяющей организовать контроль в режиме реального времени.
На практике реализация инновационного подхода выглядит следующим образом:
- Изучение природы изменчивости (вариации), которая присуща создаваемому продукту;
- Определение критических показателей качества и критических параметров процесса;
- Определение характера взаимосвязи изменчивости критических параметров качества от изменчивости критических параметров процесса;
- Описание области проектных решений (DesignSpace);
- Формирование стратегии контроля качества;
- Автоматизация контроля;
- Организация выпуска по параметрам.
Более детально см. выступление «Внедрение концепции Quality-by-Design при разработке дженериков» (гитепссылка)
И самое главное, меняется роль Уполномоченного Лица. Теперь его функция не столько принятие решения о возможности выпуска серии на рынок по принципу «контроль на конце трубы», сколько «создание этой самой трубы», устанавливающей правила поведения производственного процесса для достижения качества продукта.
Заключение
Подведем черту. Основная логика Большой Фармы в следующем:
- Входной лабораторный контроль неэффективен
- Приемочный контроль излишен при управляемом производственном процессе,
- Межоперационный контроль будет эффективен только тогда, когда мы знаем что?, где? и когда? мы делаем.
Сами по себе концепции QbD и РАТ не считаются сложными, но их реализация требует глубоких знаний и серьезной доказательной базы, основанной на многократных экспериментальных данных.
Справедливости ради, хотелось бы вспомнить слова Эдварда Деминга из его книги «Out of Crisis»: «Зависимость от проверки напоминает лечение симптомов, в то время как болезнь убивает человека. Необходимость в проверке возникает в результате излишней изменчивости процесса. Изменчивость – это и есть болезнь. Устранение зависимости от проверок означает, что вы должны понимать и знать свои процессы настолько хорошо, чтобы предугадывать качество выпущенной продукции на основе последовательных видов деятельности и измерений. Чтобы справиться с этой задачей, необходимо иметь полное представление об источниках изменчивости в ваших процессах, и работать над снижением этой изменчивости. Устранение зависимости от проверок заставит вас снизить уровень самой изменчивости»
Фармацевтический рынок растет, показывая очень хорошую динамику развития. И если наши (отечественные) производители и регуляторные органы в ближайшее время не возьмут на вооружение подходы лидеров мирового рынка, мы на долгие годы неизбежно отстанем в знаниях и инновациях. Соответственно мы никогда не сможем составить конкуренции мировому фармацевтическому сообществу. И не столько по качеству (которое мы обязаны обеспечить независимо от подходов и затраченных ресурсов), сколько по эффективности организации производства лекарственных средств.
А так этого хочется, дерзайте!
- 29.05.2018 ВИАЛЕК получил лицензию на образовательную деятельность
28 мая 2018 г. ВИАЛЕК получил лицензию на осуществление образовательной деятельности для российского подразделения компании. - 05.07.2016 VII Международная выставка оборудования и технологий для фармацевтической промышленности PHARMATechExpo
18-20 октября 2016 года в ВЦ «КиевЭкспоПлаза» состоится VII Международная выставка оборудования и технологий для фармацевтической промышленности PHARMATechExpo – единственная в Украине выставка, в рамках которой представлен весь процесс фармацевтического производства: от разработки субстанций и контроля качества сырья, оборудования для производства фармацевтических препаратов и упаковочных технологий до транспортировки, хранения лекарственных средств и подбора персонала.
Источник