- Что такое тсх лекарственных средств
- Тонкослойная хроматография (ОФС.1.2.1.2.0003.15)
- Область применения
- Основные приборы и материалы
- Хроматографические пластинки
- Хроматографические камеры
- Подвижные фазы
- Нанесение проб
- Способы элюирования
- Восходящая хроматография
- Горизонтальная хроматография
- ВИЗУАЛЬНАЯ ОЦЕНКА
- Идентификация
- Испытание на посторонние примеси
- КОЛИЧЕСТВЕННЫЕ ИЗМЕРЕНИЯ
- Высокоэффективная тонкослойная хроматография
Что такое тсх лекарственных средств
В экспертно-криминалистической деятельности сотрудниками правоохранительных органов применяются методы качественного и количественного анализа. Основными этапами анализа являются: отбор проб, пробоподготовка исследуемого вещества, переведение определяемых компонентов (ионы, молекулы) в форму, пригодную для анализа; количественное определение каждого компонента препарата; статистическая обработка данных анализа. К методам, применяемым в экспертизе наркотических средств, предъявляются строгие требования: концентрация искомого компонента оценивают в пробе, взятой для анализа, количество пробы строго фиксируется, чувствительность анализа должна быть высокой; метод должен обладать универсальностью; метод должен отличаться воспроизводимостью и метрологической надежностью; экспрессные методы предпочтительнее, низкая стоимость анализа предусматривает использование недорогой аппаратуры, реактивов, низкие затраты нормо-часов эксперта; дистанционные технологии для использования метода; метод не требует разрушения исследуемого объекта; иинновационные технологии, позволяющие автоматизировать анализ [8].
Правила отбора проб должны неукоснительно соблюдаться, отбор осуществляют в зависимости от свойств объекта судебной экспертизы. При пробоподготовке эксперт чаще всего для извлечения искомых веществ из анализируемого объекта и их последующего концентрирования применяет экстракцию и адсорбцию [6]. В качественном анализе устанавливают присутствие искомого компонента с использованием характеристических реакций, сопровождающихся тем или иным видимым эффектом: окрашивание раствора, образование или растворение осадка, выделение пузырьков газа. Из большого числа реакций для производства судебной экспертизы наркотических средств пригодны те, которые протекают быстро, необратимо и обладают высокой чувствительностью. Большинство реакций протекают в растворах, их выполняют доступными реактивами (вода, органические растворители, раствор аммиака, минеральные кислоты и др.).
В изучение нами привлекались лекарственные средства, часто поступающие на экспертизу в экспертно-криминалистические подразделения Волгоградской области: пенталгин (таблетки белого цвета, Россия); седальгин-нео (таблетки белого цвета, Россия), пиралгин (таблетки белого цвета, Беларусь); тетралгин (таблетки белого цвета, Чехия); валокордин (бесцветная жидкость с характерным запахом, Германия), беллатаминал (таблетки светло-желтого цвета, Россия), валосердин (бесцветная жидкость со специфическим запахом, Россия), седал-м (таблетки белого цвета, Болгария), корвалол (бесцветная жидкость со специфическим запахом, Россия), андипал (таблетки белого цвета, Россия). В качестве «свидетелей» использовали производные барбитуровой кислоты: барбитал (5,5-диэтилбарбитуровая кислота), гексобарбитал, тиопентал натрия отнесены к наркотическим средствам, и фенобарбитал (относится к сильнодействующим веществам). Определение производных барбитуровой кислоты в объектах проводили с помощью комплекта «Наркотест», состоящего из одиннадцати реакционных пакетов, каждый из которых включает в себя пластмассовый зажим, порционный шпатель, две ампулы с реактивом и полиэтиленовый пакет [3, с. 48]. Отличительной особенностью цветной химической реакции являлось применение реакционноспособных реагентов, обеспечивающих быстрое проведение анализа [9, c. 53].
Анализ проводили следующим образом: реакционному пакету с маркировкой «Ф2» придавали вертикальное положение и снимали с него зажим; далее извлекали из него мерный шпатель и с его помощью помещали в пакет две порции исследуемого вещества, например, порошок растертой таблетки тетралгина (одна порция вещества равна объему выступа шпателя). Затем закрепляли зажим и раздавливали левую ампулу с 5 % раствором нитрата кобальта в изопропаноле и встряхивали полученную смесь в течение 10–15 с. В последующем раздавливали ампулу с 10 % раствором пиридина в изопропаноле и снова встряхивали в течение 10–15 с. После этих операций, путем сличения окраски получившейся смеси с эталонной цветовой меткой, нарисованной на реакционном пакете, констатировали факт того, что в исследуемом веществе возможно присутствие производных барбитуровой кислоты, т.к. голубая окраска различной интенсивности вплоть до синего в указанном опыте предположительно может указывать на присутствие барбитурата [4]. Но такую же реакцию могут давать и ненаркотические средства (аскофен, цитрамон). Поэтому проводили подтверждающую реакцию с реагентами из теста с маркировкой «Ф9». В пакет помещали две порции исследуемого объекта. Раздавливали левую ампулу с 0,5 % раствором сульфата меди в 5 % растворе пиридина и встряхивали полученную смесь в течение 10-15 с. Далее раздавливали ампулу с хлороформом и снова встряхивали смесь в течение 1–2 мин. Давали смеси расслоиться, путем сличения окраски получившихся слоев жидкости с эталонной цветовой меткой, нарисованной на реакционном пакете, констатировали вывод о том, что в объекте возможно присутствуют производные барбитуровой кислоты (голубое окрашивание различной интенсивности вплоть до синего).
Определение барбитуратов при помощи качественных (капельных) цветных химических реакций, предназначенных для проведения анализа на фарфоровых или стеклянных пластинах с углублениями (плашках), куда помещаются образцы объектов, которые обрабатываются реагентами. С помощью скальпеля брали 15 мг растертого порошка таблетки «Белатаминал» и помещали его на предметное стекло. Далее прибавляли 0,5 мл 5 % раствора нитрата кобальта в изопропаноле, содержимое на плашке растворялось. Затем прибавляли 0,5 мл 10% раствора пиридина в изопропаноле. Полученная смесь приобретала фиолетовое окрашивание, что указывает на возможное наличие в объекте барбитурата. У образцов сравнения (парацетомол, левомецитин, ацетилсалициловая кислота) подобного окрашивания после обработки не наблюдалось.
Реакцию барбитуратов с нитратом ртути осуществляли следующим образом: 30 мг растертого порошка таблетки «Белатаминал» с помощью скальпеля помещали на предметное стекло, далее растворяли порошок в этаноле и прибавляли 2 мл насыщенного раствора нитрата ртути. Появление черного окрашивания свидетельствовало о возможном наличии в исследуемом препарате контролируемого барбитурата. У образцов сравнения (парацетомол; левомецитин; ампициллин, ацетилсалициловая кислота) подобного развития окраски после обработки реагентом не наблюдалось. Т.о., фиолетовое окрашивание с нитратом кобальта и черное окрашивание с нитратом ртути позволяют полагать, что в исследуемом веществе возможно присутствуют производные барбитуровой кислоты.
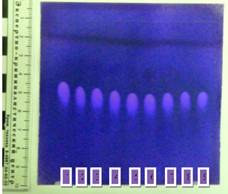
Метод тонкослойной хроматографии (ТСХ) является наиболее точным по сравнению с предшествующими методами, т. к. его реализация позволяет надежно дифференцировать и идентифицировать сложные смеси веществ. Измельченные навески исследуемых объектов №№ 1–8 (1 – пенталгин; 2 – седалгин-нео; 3 – беллатаминал; 4 – андипал; 5 – тетралгин; 6 – валосердин; 7 — корвалол; 8 – валокардин) обрабатывали десятикратным количеством этанола. Этанольные растворы объектов №№ 1-8 в количестве по 3 мкл наносили на две пластины «Sorbfil ПТСХ-П-В-УФ-254» (ЗАО «Сорбполимер», г. Краснодар). В качестве свободного образца на эти пластины наносили раствор фенобарбитала (свидетель). Хроматографирование осуществляли в системе диэтилэфир: хлороформ (в объемном соотношении 1:3) в хроматографической камере. После окончания хроматографирования пластины высушивали при комнатной температуре до полного испарения растворителей и рассматривали в ультрафиолетовых лучах кварцевой лампы (254 нм), отмечая при этом выявленные зоны гашения люминесценции. Затем полученные хроматограммы проявляли: одну пластину опрыскивали 0,03 % раствором дефинилкарбазона (ДФК) в хлороформе, а затем раствором сульфата ртути. На хроматограмме экстрактов объектов выявляли зоны, соответствующие по гашению люминесценции, окраске (красно-фиолетовая) и значению Rf (0,54), с зоной фенобарбитала (рис. 1); другую пластину – насыщенным раствором нитрата ртути. На хроматограмме экстрактов объектов выявлены зоны, соответствующие по гашению люминесценции, окраске (черная) и значению Rf (0,54), с зоной фенобарбитала (рис. 2).
Рис. 1. Вид хроматограммы после ТСХ- анализа (система диэтилэфир-хлороформ, проявитель раствор ДФК+хлороформ). 1 – пенталгин; 2 – седалгин-нео; 3 – беллатаминал; 4 – андипал; 5 – тетралгин; 6 – валосердин; 7 – корвалол; 8 – валокардин; 9 – фенобарбитал
Рис. 2. Вид хроматограммы после ТСХ анализа (система диэтилэфир – хлороформ, проявитель раствор нитрата ртути). 1 – пенталгин; 2 – седалгин-нео; 3 – беллатаминал; 4 – андипал; 5 – тетралгин; 6 – валосердин; 7 – корвалол; 8 – валокардин; 9 – фенобарбитал
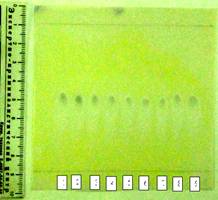
Измельченные навески объектов №№1–8 обрабатывали десятикратным количеством этанола. Полученные растворы объектов №№1–8 в количестве по 3 мкл наносили на две пластины «Sorbfil ПТСХ-П-В-УФ-254». В качестве свободного образца на эти же пластины наносили раствор фенобарбитала (свидетель). Хроматографирование проводили в системе ацетон : гексан : 25% раствор аммиака (в объемном соотношении 20:20:1). После окончания хроматографирования пластины высушивали в токе теплого воздуха в течении 20 мин. до полного испарения растворителей. Затем полученные хроматограммы обрабатывали: одну пластину – 0,03 % раствором ДФК в хлороформе, а затем раствором сульфата ртути; на хроматограмме экстрактов объектов выявлены зоны, соответствующие по гашению люминесценции, окраске (красно-фиолетовая) и значению Rf (0,17), с зоной фенобарбитала (рис. 3); другую пластину – насыщенным раствором нитрата ртути; на хроматограмме экстрактов объектов выявлены зоны, соответствующие по гашению люминесценции, окраске (черная) и значению Rf (0,17), с зоной фенобарбитала (рис. 4).
Рис. 3. Вид хроматограммы после ТСХ анализа (система: ацетон-гексан – аммиак, проявитель раствор ДФК+хлороформ). 1 – пенталгин; 2 – седалгин-нео; 3 – беллатаминал; 4 – андипал; 5 – тетралгин; 6 – валосердин; 7 – корвалол; 8 – валокардин; 9 – фенобарбитал
Рис. 4. Вид хроматограммы после ТСХ анализа (система ацетон-гексан – 25% раствор аммиака, проявитель раствор нитрата ртути). 1 – пенталгин; 2 – седалгин-нео; 3 – беллатаминал; 4 – андипал; 5 – тетралгин; 6 – валосердин; 7 – корвалол; 8 – валокардин; 9 – фенобарбитал
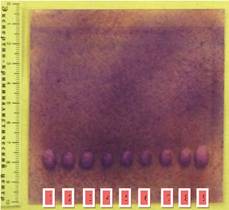
На следующем этапе устанавливали вид барбитурата, обнаруженного в исследуемом объекте. ТСХ анализ проводили в системе диэтилэфир : хлороформ (в объемном соотношении 1:3), проявляли хроматограмму раствором нитрата ртути. Измельченные навески объектов №№ 1–4 (1 – тетралгин; 2 – веронал; 3 – циклонал, 4 – фармотал) обрабатывали этанолом. Этанольные экстракты объектов в количестве по 3 мкл наносили на хроматографическую пластину. В качестве свободных образцов на пластину наносили растворы фенобарбитала – № 5, барбитала (5,5-диэтилбарбитуровая кислота) – № 6, гексобарбитала – № 7 и тиопентала натрия – № 8 (свидетели). В результате исследования на хроматограмме экстрактов объектов выявлены зоны, соответствующие по окраске (черного цвета) и значениям Rf зонам: фенобарбитала (0,54), барбитала (0,58), гексобарбитала (0,48) и тиопентала натрия (0,35) соответственно. Использование ТСХ анализа позволяет дифференцировать производные барбитуровой кислоты между собой (рис. 5) и идентифицировать объект исследования.
Рис. 5. Вид хроматограммы после ТСХ анализа (дифференциация барбитуратов между собой). 1 – тетралгин; 2 – веронал; 3 – циклонал, 4 – фармотал, 5 – фенобарбитал, 6 – барбитал, 7 – гексобарбитал, 8 – тиопентал натрия
ТСХ проста, экспрессна и информативна, на примере барбитуратов продемонстрирован алгоритм действий эксперта, направленный на разделение и идентификацию составляющих смесь, легко реализуемый в небольших криминалистических лабораторий районных отделов внутренних дел, передвижных криминалистических лабораторий и при работе на месте происшествия [1, с. 34]. ТСХ эффективно применяется на предварительной стадии исследования вещественных доказательств [5, 7].
Методы криминалистического исследования наркотических средств применяют в соответствии с частными задачами, которые предложено решить эксперту: установление качественного состава компонентов исследуемых веществ; определение количественного содержания физиологически активного компонента (барбитурата) при возможности построения калибровочных графиков содержания искомого компонента [2, 10] в смеси; криминалистическая интерпретация полученных результатов.
Рецензенты:
Аширбекова М.Т., д.ю.н., доцент, профессор кафедры уголовно-правовых дисциплин Волгоградского филиала РАНХ и ГС при Президенте РФ, г. Волгоград;
Лобачева Г.К., д.х.н., профессор, Президент Волгоградского отделения Международной академии авторов научных открытий и изобретений, г. Волгоград.
Источник
Тонкослойная хроматография (ОФС.1.2.1.2.0003.15)
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Тонкослойная хроматография (ОФС.1.2.1.2.0003.15)
Тонкослойная хроматография (хроматография в тонком слое сорбента) – хроматографический процесс, протекающий при движении подвижной фазы в тонком слое сорбента, нанесенном на инертную твердую подложку (пластинку) из соответствующего материала – стекла, металла или полимера.
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ст. ГФ XI, вып.1
Тонкослойная хроматография (ТСХ) может использоваться для анализа как однокомпонентных, так и многокомпонентных лекарственных средств. В последнем случае подбираются условия хроматографирования, обеспечивающие разделение компонентов смеси.
Разделение может осуществляться по различным механизмам: адсорбционному, распределительному, ионообменному или какой-либо их комбинации.
Хроматографическое разделение осуществляется в результате движения анализируемых веществ в тонком слое (неподвижной фазе), растворенных в растворителе или соответствующей смеси растворителей (подвижная фаза, элюент). При разделении вещества образуют на поверхности сорбента зоны адсорбции в виде пятен (круглых или эллипсовидных) или полос.
Подвижность вещества при его хроматографировании характеризуется величинами Rf и Rst (см. ОФС «Хроматография»).
Параметры Rf и Rst используются для идентификации веществ и для оценки разделительной способности системы.
Область применения
Тонкослойная хроматография используется при испытаниях лекарственных средств на подлинность (идентификация анализируемых веществ), посторонние примеси (испытание на чистоту) полуколичественным и количественным методами.
Основные приборы и материалы
- пластинки с закрепленным слоем сорбента (неподвижной фазы) различных модификаций;
- хроматографические камеры;
- калиброванные капилляры и микрошприцы;
- устройства для нанесения на хроматограммы обнаруживающих реаген-тов (пульверизаторы для опрыскивания, камеры для погружения хро-матограмм в раствор и др.);
- стандартные образцы, растворители, реагенты для обнаружения хрома-тографических зон;
- ультрахемископы с УФ-лампами на 254 и 365 нм;
- системы обработки и хранения данных.
Используемая лампа должна удовлетворять следующим требованиям теста.
Проверка работы лампы. На пластинку силикагель G наносят 5 мкл 0,04 % раствора натрия салицилата в спирте 96 % для ламп с максимумом излучения при 254 нм или 5 мкл 0,2 % раствора натрия салицилата в спирте 96 % для ламп с максимумом излучения при 365 нм в виде пятна диаметром около 5 мм; пятно должно светиться. Проверка работы ламп проводится не реже одного раза в три месяца, а также при возникновении сомнений в правильности работы лампы с учетом срока её эксплуатации.
При проведении анализов расстояние между лампой и хроматографической пластинкой не должно превышать расстояния, используемого при проверке работы лампы.
Примечание. Используемый спирт должен быть свободен от флуоресцирующих веществ.
Хроматографические пластинки
Пластинка для тонкослойной хроматографии представляет собой твердую подложку (стеклянную, металлическую или полимерную) с нанесенным слоем сорбента. Толщина слоя сорбента от 0,10 до 0,25 мм для аналитического варианта и от 0,5 до 2,0 мм для препаративного.
В качестве сорбента в пластинках для тонкослойной хроматографии чаще всего используются: алюминия оксид, модифицированный и немодифицированный силикагель, модифицированная и немодифицированная целлюлоза.
Готовые хроматографические пластинки могут содержать флуоресцентный индикатор для детектирования веществ, поглощающих в ультрафиолетовой области спектра при 254 и 365 нм.
Размер частиц сорбента для классического аналитического варианта ТСХ составляет 10 – 20 мкм. Наряду с такими пластинками можно использовать пластинки для высокоэффективной тонкослойной хроматографии, содержащие сорбент с частицами размером 5 – 7 мкм. Такие пластинки позволяют увеличить эффективность разделения и уменьшить предел обнаружения.
Выпускаются также пластинки с монолитными сорбентами и пластинки с концентрирующей зоной (двухфазовые пластинки). Последние используются в фармацевтическом анализе для разделения сложных и гетерогенных смесей (экстракты из лекарственного растительного сырья, растворы таблеток со вспомогательными компонентами, мягкие лекарственные формы, смеси, содержащие пигменты, суспензии и др.).
Предварительная подготовка пластинок. В некоторых случаях перед хроматографированием предусмотрена предварительная обработка пластинок. Это может быть предварительное хроматографирование чистых пластинок в соответствующем растворителе, импрегнирование пластинок при помощи опрыскивания, погружения или элюирования. При необходимости перед использованием пластинки активируют нагреванием в сушильном шкафу в течение 1 ч при температуре 100 – 105 °С. Описание предварительной обработки пластинок должно быть приведено в фармакопейной статье.
Хроматографические камеры
Используют хроматографические камеры для вертикального или горизонтального элюирования с герметичными крышками. Камеры для горизонтального элюирования снабжены также устройствами для подачи подвижной фазы на пластинку. Использование камеры для горизонтального элюирования позволяет осуществлять одновременное элюирование с противоположных сторон пластинки, что увеличивает производительность анализа в два раза по сравнению с использованием камеры для вертикального элюирования. при этом также уменьшается расход подвижной фазы приблизительно в 10 раз. В горизонтальной камере движение подвижной фазы по пластинке происходит только за счет капиллярных сил, вклад гравитации при этом отсутствует, что повышает эффективность разделения по сравнению с камерами для вертикального элюирования.
Подвижные фазы
Подвижные фазы (элюенты) должны быть предпочтительно малотоксичными, содержать минимум компонентов, не вступать в химические реакции ни с сорбентом (неподвижной фазой), ни с компонентами разделяемой смеси. Подвижные фазы должны также достаточно быстро испаряться с поверхности хроматограмм после элюирования.
Для подавления диссоциации полярных молекул компонентов разделяемой смеси к подвижной фазе добавляют вещества кислого или основного характера (модификаторы).
Нанесение проб
Нанесение проб осуществляют:
- калиброванными капиллярами с тупым концом;
- поршневыми микрошприцами с тупым концом иглы;
- полуавтоматическими или автоматическими приборами для нанесения образцов.
Нанесение осуществляют двумя способами: в виде пятен 2 – 5 мм диаметром (1 – 2 мм на высокоэффективных пластинках) с промежутками между пятнами не менее 10 мм и в виде полос длиной 10 – 20 мм (5 – 10 мм на высокоэффективных пластинках) с промежутком между ними не менее 10 мм. Расстояние до линии старта от нижнего края пластинки должно составлять не менее 10 мм. Если в методике фармакопейной статьи предусмотрено использование как обычных, так и высокоэффективных пластинок, условия для высокоэффективных пластинок должны быть указаны в квадратных скобках. Расстояния на стартовой линии от боковых краев пластинки до мест нанесения первой и последней проб должны составлять не менее 10 мм. В процессе нанесения проб недопустимо повреждение сорбента на линии старта. Подсушивание нанесенных проб осуществляют в токе холодного или теплого воздуха, либо на специальном столе с электроподогревом.
Способы элюирования
Используют следующие способы элюирования: восходящее элюирование (одно- и многоступенчатое, одномерное и двумерное – с поворотом пластинки на 90° или 180°) и горизонтальное.
Восходящая хроматография
Если не указано иначе в фармакопейной статье, пластинку с нанесенными пробами помещают вертикально в камеру. При необходимости камеру предварительно насыщают парами подвижной фазы (в этом случае в фармакопейной статье должно быть указано время насыщения). Для этого перед проведением анализа обычно внутренние стенки камеры обкладывают фильтровальной бумагой, смоченной подвижной фазой. Уровень подвижной фазы должен быть расположен ниже линии старта. Камеру закрывают и проводят процесс при 20 – 25 °С в защищенном от света месте. После прохождения фронтом подвижной фазы расстояния, указанного в нормативном документе, пластинку вынимают из камеры, сушат до удаления следов растворителей, проявляют и детектируют зоны адсорбции указанным способом.
При проведении двумерной хроматографии пластинку сушат после хроматографирования в первом направлении и хроматографируют в направлении, перпендикулярном первому.
Горизонтальная хроматография
Пластинку с нанесенными пробами помещают в камеру и направляют поток подвижной фазы из лотка в камеру согласно инструкции к прибору для горизонтального элюирования. Процесс проводят при 20 – 25 °С (если это указано в фармакопейной статье, одновременно с противоположных сторон пластинки). Когда подвижная фаза пройдет расстояние, указанное в нормативном документе, пластинку вынимают, сушат до удаления следов растворителей, проявляют и детектируют зоны адсорбции указанным способом.
Двухмерную хроматографию выполняют, как указано в разделе «Восходящая хроматография».
ВИЗУАЛЬНАЯ ОЦЕНКА
Обнаружение (детектирование) зон адсорбции после проведения качественной и полуколичественной ТСХ осуществляют следующими способами:
- в видимом и ультрафиолетовом свете (при определенной длине волны);
- опрыскиванием растворами обнаруживающих реагентов;
- выдерживанием в парах обнаруживающего реагента;
- погружением в растворы обнаруживающих реагентов с использованием для этих целей специальных камер.
Идентификация
Испытание на подлинность (идентификация) анализируемых веществ проводится при одновременном хроматографировании одинакового количества анализируемого вещества и стандартного образца на одной и той же хроматографической пластинке. Основную зону адсорбции (пятно или полосу) на хроматограмме испытуемого раствора сравнивают с основной зоной адсорбции (пятном или полосой) на хроматограмме стандартного раствора (раствора сравнения), сравнивая окраску (цвет флуоресценции), размер и величину фактора Rf соответствующих зон адсорбции (ОФС «Хроматография»).
Испытание на посторонние примеси
При испытаниях на чистоту основное вещество и примеси в условиях хроматографирования должны иметь разные значения Rf. При этом о степени чистоты анализируемого вещества можно судить по величине и интенсивности зон адсорбции обнаруживаемых на хроматограмме примесей. Их содержание может быть определено полуколичественно. Для этого на пластинку наносят определенные количества анализируемого вещества и свидетелей. Для определения идентифицированных примесей в качестве свидетелей используют стандартные образцы идентифицированных примесей в количествах, соответствующих их предельно допустимому содержанию. Для определения неидентифицированных примесей чаще всего используют растворы сравнения, приготовленные путем разведения испытуемого раствора. Содержание примеси в анализируемом лекарственном средстве оценивают, сравнивая зону адсорбции примеси по совокупности величины и интенсивности поглощения или окраски с соответствующими зонами адсорбции на хроматограмме свидетелей. Дополнительное пятно (пятна) на хроматограмме испытуемого раствора сравнивают визуально с дополнительным пятном (пятнами) на хроматограмме стандартного раствора, содержащего примесь (примеси), или с пятном на хроматограмме раствора сравнения, приготовленного из разбавленного испытуемого раствора.
Проверка разделительной способности хроматографической системы
Требования к проверке разделительной способности приводят в фармакопейной статье.
Проверка определения предела обнаружения определяемых примесей
Чувствительность считается удовлетворительной, если зона адсорбции четко обнаруживается на хроматограмме наиболее разбавленного стандартного раствора примеси или раствора сравнения.
КОЛИЧЕСТВЕННЫЕ ИЗМЕРЕНИЯ
Если вещества, разделяемые методом тонкослойной хроматографии реагируют на излучение в ультрафиолетовой или видимой области спектра, их можно количественно определить непосредственно на пластинке, используя соответствующее оборудование. Для этого измеряют интенсивность отраженного света, передвигая пластинку или регистрирующее устройство вдоль оси хроматограммы. Аналогичным образом можно измерять флуоресценцию.
Вещества, содержащие радионуклиды, могут быть количественно определены непосредственно на пластинке с использованием соответствующего счетчика радиоактивных веществ, а также удалением неподвижной фазы в районе зон адсорбции и измерением радиоактивности с использованием жидкостного сцинциляционного счетчика.
Оборудование. Для проведения количественных измерений непосредственно на хроматографической пластинке оборудование содержит:
- полуавтоматическое или автоматическое устройство для точного и воспроизводимого нанесения необходимого количества вещества в определенном месте пластинки;
- фотометр (денситометр), способный перемещать пластику или измерительное устройство вдоль осей «x» и «y», с источником монохроматического излучения для измерения отражения или пропускания; в том случае, когда измеряется флуоресценция, требуется дополнительный монохроматический фильтр для выбора соответствующей спектральной области излучаемого света; полученные в результате денситограммы обрабатывают в соответствии с методом обработки хроматограмм, описанным в ОФС «Хроматография».
Критерии оценки пригодности системы описаны в ОФС «Хроматография». В этой же ОФС приводятся пределы изменения параметров хроматографической системы, которые допустимы для выполнения условий пригодности.
Высокоэффективная тонкослойная хроматография
Эффективность разделения увеличивается как вследствие увеличения площади раздела подвижной и неподвижной фазы за счет уменьшения диаметра частиц сорбента, так и благодаря большей однородности размеров этих частиц. Применяют пластинки для высокоэффективной тонкослойной хроматографии, выполненные как в нормально-фазовом (полярная неподвижная фаза), так и в обращенно-фазовом (неполярная неподвижная фаза) вариантах.
По сравнению с классической ТСХ использование высокоэффективных пластинок позволяет:
- увеличить число анализируемых проб за счет уменьшения размеров зон адсорбции первичной хроматограммы: диаметра пятен (до 1 – 2 мм) или длины полос (до 5 – 10 мм);
- значительно увеличить разделительную способность системы;
- снизить пределы обнаружения и количественного определения анализируемых веществ в 10 – 100 раз.
Применение высокоэффективной тонкослойной хроматографии обеспечивает получение более компактных зон адсорбции разделяемых соединений, что улучшает метрологические характеристики количественного определения с помощью сканирующей хроматоденситометрии.
Источник