- Субстанция (фармакология)
- Полезное
- Смотреть что такое «Субстанция (фармакология)» в других словарях:
- Фармакологические субстанции и лекарственные препараты – в чем разница?
- Фармацевтические субстанции (ОФС.1.1.0006.15)
- Описание.
- Растворимость.
- Подлинность.
- Температура плавления.
- Температура затвердевания. Температура кипения (температурные пределы перегонки), Плотность, Вязкость, Показатель преломления.
- Удельное вращение.
- Удельный показатель поглощения.
- Прозрачность раствора, Цветность раствора.
- pH и Кислотность или Щелочность.
- Родственные примеси
- Неорганические анионы (хлориды, сульфаты и др.).
- Неорганические катионы (железо, медь и др.).
- Потеря в массе при высушивании или Вода.
- Сульфатная зола.
- Тяжелые металлы.
- Мышьяк.
Субстанция (фармакология)
Субста́нция (лат. substantia — сущность; то, что лежит в основе) — вещество надлежащей чистоты, из которого в промышленности изготавливают лекарственные средства и лекарственные формы. В этом случае субстанция — это одновременно и синоним действующего вещества, и обозначение для стандартизованных полуфабрикатов для лекарств, изготавливаемых согласно Фармакопее.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Субстанция (фармакология)» в других словарях:
Субстанция (значения) — Субстанция: Субстанция (философия) философское понятие классической традиции. Субстанция (фармакология) вещество надлежащей чистоты, из которого в промышленности изготавливают лекарственные средства и лекарственные формы … Википедия
Лекарственные средства — (лекарственные препараты, медикаменты) (новолат. praeparatum medicinale, новолат. praeparatum pharmaceuticum, новолат. medicamentum[1]; жарг. лечебное средство, лекарство) лекарственное вещество, субстанция или смесь… … Википедия
Морфин (лекарственное средство) — Эта статья о лекарственном средстве; о веществе см.: Морфин … Википедия
Натрия оксибутират — Натрия оксибутират … Википедия
Кагоцел — «Кагоцéл» (Kagocel) российский препарат противовирусного действия. Относится к группе индукторов интерферона, стимулирующих в организме человека продукцию собственного интерферона. Основное действующее вещество сополимер госсипола… … Википедия
Фонтурацетам — (Fonturacetamum) Химическое соед … Википедия
Китай — Китайская Народная Республика, КНР (кит. Чжунхуа жэньминь гунхэго). I. Общие сведения К. крупнейшее по численности населения и одно из крупнейших по площади государств в мире; расположен в Центральной и Восточной Азии. На востоке … Большая советская энциклопедия
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
Источник
Фармакологические субстанции и лекарственные препараты – в чем разница?
Автор: Свиржевская Елизавета Леонидовна, кандидат ветеринарных наук, научный сотрудник ООО «БИОТЕСТЛАБ»
Фармакологическая субстанция– лекарственное средство в виде одного или нескольких обладающих фармакологической активностью действующих веществ, вне зависимости от природы происхождения, которое предназначено для производства, изготовления лекарственных препаратов.
Лекарственные препараты– лекарственные средства в виде лекарственных форм, применяемые для профилактики, лечения, реабилитации и т.д., прошедшие клинические испытания и разрешены к применению уполномоченными на то органами.
В чем же заключается разница между этими средствами?
При сравнении различных лекарственных средств, необходимо учитывать:
- параметры биодоступности. Различия в степени абсорбции и скорости достижения максимальной концентрации лекарственного средства могут повлиять на его качественную характеристику.
- качество лекарственного препарата. На качество влияет наличие вспомогательных веществ.
- вспомогательные веществаспособны образовывать соединения, которые способствуют высокой степени растворения и биодоступности и могут влиять на терапевтическую эффективность.
Разработчик лекарственного препарата целенаправленно подбирает концентрацию действующих веществ и вспомогательные компоненты для достижения максимального воздействия на патоген и минимального негативного на организм.
Перед началом производства лекарственный препарат проходит несколько полных циклов клинических испытаний с оценкой эффективности, в ходе которых учитывают не только количество больных и выздоровевших животных, но и оценивают продолжительность лечения, дозу препарата, отсутствие негативных реакций, результаты лабораторных исследований, совместимость с другими препаратами и обработками. Эффективность и безвредность препарата, наряду с другими показателями, в обязательном порядке подтверждаются доклиническими и клиническими исследованиями в контрольном институте при процедуре государственной регистрации.
В целях снижения затрат врачи ветеринарной медицины, закупщики ветеринарных препаратов стремятся к поиску недорогих субстанций. Часто их качество оказывается невысоким. Причиной может быть изменение методов синтеза (токсические примеси и т.д.), поскольку многие субстанции производятся в странах с различными условиями и методами контроля. Также стоит сказать, что связь поставщиков с клиентами нередко осуществляется через множество посредников, которые имеют дело с несколькими производителями субстанций. Кроме того, в состав субстанции не входят вспомогательные вещества, и это может существенно повлиять на её качество, биодоступность, привести к токсическим и аллергическим реакциям. Помимо этого, субстанции содержат в своем составе ряд неидентифицированных веществ, в том числе остатки органических растворителей, которые повышают токсичность корма.
Обратите внимание, что в инструкции по применению субстанция указана как концентрат, который используют при производстве готовых лекарственных форм антибактериальных препаратов для терапевтического применения животным.
Применять субстанцию или препарат, который прошел доклинические и клинические испытания по безопасности и эффективности, – выбор пользователей. В случае использования субстанций ответственность за возможные негативные или неэффективные результаты разделить с производителем или продавцом субстанции не получится, ввиду их нецелевого использования.
Источник
Фармацевтические субстанции (ОФС.1.1.0006.15)
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Фармацевтические субстанции (ОФС.1.1.0006.15)
Взамен ГФ XII, ч. 1, ОФС42-0074-07
Фармацевтические субстанции — лекарственные средства в виде одного или нескольких обладающих фармакологической активностью действующих веществ вне зависимости от природы происхождения, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность.
Требования данной статьи распространяются преимущественно на фармацевтические субстанции химического и минерального происхождения. Для субстанций, представляющих собой стандартизованную смесь биологически активных веществ растительного или животного происхождения возможны отклонения от данных требований или дополнительные требования, указанные в фармакопейных статьях.
Требования данной статьи распространяются также на вспомогательные вещества, используемые при производстве/изготовлении лекарственных препаратов.
В качестве названия фармакопейной статьи на фармацевтическую субстанцию используется общепринятое название. Многие субстанции представляют собой соли органических кислот и органических оснований (например, Кеторолака трометамол, или Амлодипипа бесилат, или Доксазозина мезилат), органических кислот и неорганических оснований (например. Диклофенак натрия), неорганических кислот и органических оснований (например, Кетамина гидрохлорид). Названия фармакопейных
Во вводной части фармакопейной статьи на субстанцию приводят химическое название по номенклатуре IUPAC, структурную формулу, брутто -формулу и относительную молекулярную массу
Вводимые показатели контроля качества и пределы нормирования должны соответствовать назначению субстанции (например, для производства/изготовления стерильных лекарственных препаратов, или стерильных неиньекционных лекарственных препаратов, или нестерильных лекарственных препаратов, или нестерильных лекарственных препаратов для местного и наружного применения и т.д.).
Испытания по показателям контроля качества фармацевтической субстанции проводят согласно соответствующим общим фармакопейным статьям (ОФС).
Описание.
Указывают характеристики физического состояния и цвет субстанции. Не следует включать описание вкуса. В необходимых случаях приводят информацию о запахе, гигроскопичности и полиморфизме.
Для твердых субстанций необходимо указание формы вещества: «кристаллический», «мелкокристаллический» или «аморфный порошок». Характеристика кристалличности субстанции является одним из важных параметров, от которого зависит качество твердых дозированных лекарственных препаратов.
В некоторых случаях может быть указан численный диапазон размера частиц, а также введено исследование формы кристаллов. Такие испытания выносят в отдельные разделы.
Оценка полиморфизма субстанции обязательна в тех случаях, когда полиморфная модификация определяет фармакологическую активность лекарственного препарата и его фармако-технологические свойства.
Растворимость.
Для определения растворимости следует использовать растворители, охватывающие широкую шкалу полярности, например: вода, спирт 96 %, гексан и др. Не рекомендуется использование легкокипящих и легковоспламеняющихся (например, диэтиловый эфир) или очень токсичных (например, бензол) растворителей.
Подлинность.
Для установления подлинности субстанции рекомендуются физико-химические и химические методы — инфракрасная спектрометрия, абсорбционная спектрофотометрия, ЯМР-спектроскопия, тонкослойная, газовая и высокоэффективная жидкостная хроматография (ТСХ, ГХ и ВЭЖХ) и качественные (в первую очередь специфические) химические реакции. Метод ИК-спектрометрии является приоритетным при идентификации субстанций.
Температура плавления.
Испытание обычно применяют для характеристики твердых веществ.
Температура затвердевания. Температура кипения (температурные пределы перегонки), Плотность, Вязкость, Показатель преломления.
Данные испытания вводят для характеристики жидких субстанций.
Удельное вращение.
Вводят для характеристики оптически активных веществ.
Удельный показатель поглощения.
Данный показатель может являться дополнительной характеристикой подлинности и чистоты субстанции.
Прозрачность раствора, Цветность раствора.
Данные испытания обязательно вводят для субстанций, используемых для приготовления парентеральных, глазных, назальных и ушных лекарственных средств. Испытание обычно проводят в водных растворах субстанции, но возможно использование органических и смешанных растворителей. Концентрация испытуемых растворов должна быть приближена к концентрации производимого/изготавливаемого из этой субстанции лекарственного препарата.
Определение цветности раствора особенно важно для оценки качества белых, почти белых или белых с оттенком субстанций.
Если субстанция окрашена, показатель «Цветность раствора» в нормативную документацию включать не следует. Это испытание, если необходимо, можно заменить регламентацией оптической плотности при определенных длинах волн.
pH и Кислотность или Щелочность.
Для проведения данного испытания могут использоваться два подхода: измерение pH или кислотно-основное индикаторное титрование (кислотность или щелочность). Испытание обычно проводят в водных растворах субстанции, но в отдельных случаях возможно использование и смешанных растворителей. Допустимый интервал pH обычно должен быть не более 2.
Концентрация испытуемого раствора при определении pH должна быть приближена к концентрации изготавливаемого из субстанции лекарственного препарата.
Родственные примеси
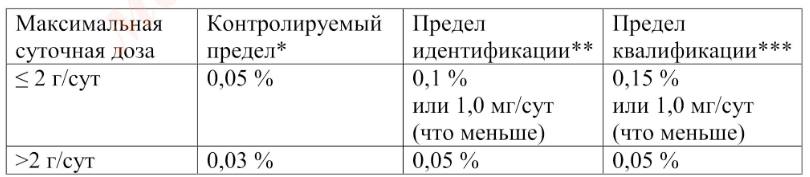
Данное испытание контролирует продукты деструкции фармацевтической субстанции и технологические примеси, обусловленные технологией производства. Примеси могут быть идентифицированные (соединения с установленным химическим строением) и неидентифицированные (соединения, строение которых не установлено). Пределы содержания родственных примесей в фармацевтических субстанциях приводят с учетом параметров их безопасности. Пределы контроля, идентификации и квалификации родственных примесей для фармацевтических субстанций (в зависимости от максимальной суточной дозы лекарственного препарата) приведены в табл. 1 и 2.
Таблица 1. Пределы контроля, идентификации и квалификации родственных примесей в фармацевтических субстанциях
* предел, выше которою примесь должна контролироваться
** предел, выше которого примесь должна быть идентифицирована
***предел, выше которого должна быть установлена биологическая безопасность примеси
Приведенные пределы учитываются при нормировании родственных примесей в фармацевтических субстанциях.
Таблица 2. Пределы контроля, идентификации и квалификации родственных примесей в пептидах, полученных синтетическим путём
| Контролируемый предел | Предел идентификации | Предел квалификации |
| >0,1 % | > 0,5 % | > 1,0% |
Для контроля родственных соединений обычно используют хроматографические и, реже, спектроскопические методы. Обязательно вводится идентификация и количественное определение токсичных примесей с использованием стандартных образцов.
Неорганические анионы (хлориды, сульфаты и др.).
Выбор контролируемых анионов определяется технологией получения субстанции. При этом контролируемые анионы могут быть нетоксичными (например, хлориды, сульфаты и т.д.).
Контроль анионов не вводят, если они входят в состав субстанции (например, субстанция является гидрохлоридом или сульфатом).
Неорганические катионы (железо, медь и др.).
Это испытание вводят, если контроль содержания отдельных катионов является существенным для качества субстанции; их содержание должно быть обосновано.
Контроль катионов не вводят, если они входят в состав субстанции (например, вещество является натриевой солыо).
Потеря в массе при высушивании или Вода.
Испытание вводят для контроля содержания летучих веществ и/или влаги в субстанции. Введение одного из этих испытаний, как правило, обязательно. Отсутствие их должно быть обосновано. Если нет других указаний в фармакопейной статье и субстанция не является кристаллогидратом (кристаллосольватом), потеря в массе при высушивании или содержание воды, как правило, не должно превышать 0,5 %. Результаты определения по этим показателям учитывают при оценке результатов количественного определения.
Если субстанция является кристаллогидратом (кристаллосольватом), регламентируют верхний и нижний пределы.
Сульфатная зола.
Как правило, сульфатная зола не должна превышать 0,1 %. Отсутствие этого испытания в фармакопейной статье или повышенное содержание сульфатной золы требует соответствующего обоснования.
Тяжелые металлы.
Устанавливаемые пределы содержания тяжелых металлов в фармацевтических субстанциях определяются максимальной суточной дозой препарата, произведенного из данной субстанции, и длительностью его возможною применения (согласно Инструкции по медицинскому применению) (табл. 3).
Мышьяк.
Данное испытание вводят в том случае, когда или исходное сырье может содержать мышьяк, например, для сырья природного происхождения, или возможно загрязнение им в процессе получения субстанции. Содержание мышьяка, как правило, не должно превышать 0,0001 %.
Таблица 3. Критерии для нормирования допустимого содержания тяжелых металлов
Источник