- Фармакомониторинг
- Лекарственные средства
- Счетчик обращений граждан и организаций
- Лекарственные средства
- Мониторинг эффективности и безопасности лекарственных препаратов
- Мониторинг движения лекарственных препаратов (маркировка лекарств)
- Человеческий ресурс
- Места хранения
- Финансовый ресурс
- Время
- Прямой порядок
- Обратный порядок
Фармакомониторинг

Для преодоления этих проблем был разработан достаточно универсальный клинический подход, под названием терапевтический лекарственный мониторинг — комплекс мероприятий по определению концентрации лекарственных веществ в физиологических жидкостях пациентов, с целью подбора оптимальной схемы дозирования, наиболее эффективной для конкретного пациента, и минимизации нежелательных побочных эффектов лекарственного препарата.
Главная цель лекарственного мониторинга – фармакокинетический контроль лекарственной терапии. Согласно приказа № 4.94 МЗ РФ от 22.10.2003 г противоэпилептические препараты (антиконвульсанты) были отнесены к перечню препаратов, применение которых следует в обязательном порядке сочетать с мониторингом их концентрации в крови. Персонализация терапии эпилепсии – современная стратегия ведения таких пациентов, которая подразумевает выбор лекарственного препарата в зависимости от индивидуальных параметров больного и особенностей фармакодинамики и фармакокинетики противоэпилептических средств.
Международная противоэпилептическая лига в 2008 г. сформулировала некоторые общие показания для проведения терапевтического лекарственного мониторинга при использовании противоэпилептических препаратов:
- Применение при впервые установленной эпилепсии (определение концентрационных значений верхней и нижней границы терапевтического коридора),
- Определение постиктального концентрационного уровня противоэпилептического препарата в плазме крови,
- При выраженных побочных эффектах (определение индивидуального «терапевтического диапазона» пациента и вместе с тем определение «индивидуального токсического порога», оценка индивидуального прогноза лечения)
- Сопровождение процесса отмены лекарственного препарата
- Для определения приверженности лечению (комплаентности)
- Для оптимизации режима дозирования у детей в период фазы роста или у пациентов с резко изменившимся, в силу различных причин, весом
- При колебании стационарной концентрации антиконвульсантов на фоне приема оральных контрацептивов
- При межлекарственных взаимодействиях
- Отсутствие терапевтического эффекта или неудовлетворительный эффект при стандартной терапевтической дозе,
- Выраженные побочные эффекты при стандартной терапевтической дозе препарата,
- При срыве ремиссии без изменения дозы,
- Индивидуальные генетические особенности
- Предполагаемые изменения фармакокинетики, например, у больных пожилого возраста, при риске межлекарственных взаимодействий, беременности;
- Замена противоэпилептического препарата на другую лекарственную форму, или на дженерик;
Существует отработанный метод взятия крови для лекарственного мониторинга под названием стратегия «пик-спад». По этой схеме кровь отбирают двукратно. Первый раз кровь забирают натощак, до приема препарата, во время максимального снижения его стационарной концентрации в крови, непосредственно перед очередным введением препарата. Считается, что остаточный уровень препарата отображает терапевтическую эффективность лекарственного средства. Второй отбор производится на концентрационном максимуме препарата, который измеряют как правило спустя 2-3 часа после перорального введения, спустя 1 час после внутримышечной инъекции и через 30 мин после внутривенного введения препарата. Предполагается, что по концентрации после приема можно судить о возможных токсических эффектах препарата.
В ФГБНУ «Научный центр неврологии» проводится терапевтический лекарственный мониторинг большинства противоэпилептических препаратов, применяемых в Российской Федерации. При необходимости, интерпретация данных лекарственного мониторинга и адекватная индивидуализация режима дозирования может быть осуществлена с привлечением высококвалифицированных врачей-эпилептологов Центра.
Ниже приведен перечень препаратов, для которых осуществляется процедура лекарственного мониторинга на базе ФГБНУ «Научный центр неврологии» с указанием цены за один анализ:
Терапевтический лекарственный мониторинг
противоэпилептических препаратов
| Фенитоин |
| Зонисамид (анализ одного образца) |
Все исследования осуществляются на современном поверенном хроматографическом и хроматомасс-спектрометрическом оборудовании. Используемые методы количественного анализа метрологически валидированны согласно рекомендациям «Руководства по экспертизе лекарственных средств МЗ РФ» и международному руководству «Guideline on bioanalytical method validation» Европейского агентства лекарственных средств (EMEA).
Источник
Лекарственные средства
Счетчик обращений граждан и организаций
Лекарственные средства
Мониторинг эффективности и безопасности лекарственных препаратов
В соответствии с п. 5.1.4.3. постановления Правительства Российской Федерации от 30.06.2004 № 323 «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения» на Росздравнадзор возложены полномочия по федеральному государственному надзору в сфере обращения лекарственных средств посредством проведения фармаконадзора.
В соответствии с п. 3 ст. 64 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» субъекты обращения лекарственных средств в порядке, установленном уполномоченным федеральным органом исполнительной власти, обязаны сообщать в уполномоченный федеральный орган исполнительной власти о побочных действиях, нежелательных реакциях, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении лекарственных препаратов, об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов, а также об иных фактах и обстоятельствах, представляющих угрозу жизни или здоровью человека при применении лекарственных препаратов и выявленных на всех этапах обращения лекарственных препаратов в Российской Федерации и других государствах.
Кроме того, в соответствии с приказом Минздравсоцразвития России от 26.08.2010 № 757н «Об утверждении порядка осуществления мониторинга безопасности лекарственных препаратов для медицинского применения, регистрации побочных действий, серьезных нежелательных реакций, непредвиденных нежелательных реакций при применении лекарственных препаратов для медицинского применения», в рамках проведения мониторинга безопасности лекарственных средств Росздравнадзор проводит анализ периодических отчетов по безопасности лекарственных препаратов, поступающих от производителей и разработчиков лекарственных препаратов.
Источник
Мониторинг движения лекарственных препаратов (маркировка лекарств)
Правительством Российской Федерации в числе основных направлений определена работа по модернизации процесса движения лекарственных препаратов в соответствии с лучшими международными практиками, в том числе по унификации и упрощению процедур вывода лекарств на рынок без ущерба качеству, проведению мониторинга ассортиментной политики и цен на лекарственные препараты, совершенствованию методики регистрации предельных отпускных цен производителей на жизненно необходимые лекарственные препараты, мониторингу движения лекарственных препаратов для медицинского применения от производителя до конечного потребителя с использованием средств идентификации.
25 октября 2016 г. президиумом Совета при Президенте Российской Федерации по стратегическому развитию и приоритетным проектам утвержден паспорт приоритетного проекта «Внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя для защиты населения от фальсифицированных лекарственных препаратов и оперативного выведения из оборота контрафактных и недоброкачественных препаратов». Краткое наименование — «Лекарства. Качество и безопасность».
Ключевые участники приоритетного проекта:
- Минздрав России;
- Росздравнадзор;
- ФНС России;
- Минпромторг России;
- Минфин России;
- Минкомсвязи России.
Субъекты обращения лекарственных препаратов:
- российские производители;
- российские и иностранные держатели регистрационных удостоверений и их представительства;
- организации оптовой и розничной торговли лекарствами;
- медицинские организации.
Цель приоритетного проекта:
- Защита населения от фальсифицированных, недоброкачественных и контрафактных лекарственных препаратов и предоставление неограниченному кругу потребителей (граждан) возможности проверки легальности зарегистрированных лекарственных препаратов, находящихся в гражданском обороте. Обеспечение прозрачности и развития справедливой конкуренции на фармацевтическом рынке.
Основными ресурсами, освещающими реализацию проекта МДЛП, являются официальные сайты Минздрава России, Росздравнадзора, Национальной системы цифровой маркировки «Честный знак». Информации в соответствующих разделах много, но в сегменте вопросов, касающихся медицинских организаций, она крайне дозированная и отвечает далеко не на все вопросы. При этом важно разобраться, что находится в силах и компетенции самой медицинской организации, и к чему придется тщательно готовиться, особенно к тем аспектам процесса лекарственного обеспечения, на которые система МДЛП влияет опосредованно, без регуляторного или технического воздействия.
Система мониторинга движения лекарственных препаратов будет внедряться с 01.07.2020 одномоментно по всей стране, вовлекая огромное число субъектов обращения лекарственных препаратов. По официальным оценкам в системе будут зарегистрированы около тысячи производителей и держателей регистрационных удостоверений на лекарственные препараты, порядка 2,5 тысяч оптовых фармацевтических организаций и 350 тысяч медицинских и аптечных организаций, не говоря о том, что эта система коснется всех без исключения конечных потребителей — пациентов, а это, без преувеличения, всё население Российской Федерации.
Эксперимент по внедрению системы маркировки лекарств в соответствии с Постановлением Правительства РФ от 24.01.2017 № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» (вместе с «Положением о проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения») стартовал в начале 2017 года и закончится непосредственно перед переходом к промышленной эксплуатации в конце 2019 года. Промежуточные результаты и опыт добровольных участников эксперимента уже сегодня объективно показывают, что задачи, стоящие перед субъектами оборота лекарственных препаратов, далеко не простые и требуют серьезной подготовки, как организационной, так и финансовой.
При подготовке к внедрению системы МДЛП руководству медицинской организации необходимо самым тщательным образом подойти к оценке готовности и достаточности всех видов её ресурсов.
Человеческий ресурс
Трудоёмкость приемки товара при внедрении системы маркировки неизбежно возрастает, особенно, если мест приемки и выбытия лекарств из гражданского оборота в организации несколько. Частично решить этот вопрос можно при применении автоматизированных средств оптимизации считывания кодов с упаковок, но на рынке пока нет доступных решений, которые бы подходили для данных целей.
Места хранения
С 29.11.2019 ст. 67 Федерального закона от 12.04.2010 № «Об обращении лекарственных средств» дополняется ч. 7.1 в следующей редакции «Лекарственные препараты для медицинского применения, введенные в гражданский оборот до 1 января 2020 года, подлежат хранению, перевозке, отпуску, реализации, передаче, применению без нанесения средств идентификации до истечения срока их годности.». Это значит, что с 1 января 2020 года поток медикаментов разделится на маркированный подтвержденный, маркированный неподтвержденный и немаркированный, что потребует увеличения площадей и мест хранения препаратов, так как совместное хранение этих групп товаров может привести к нарушению требований системы мониторинга движения.
С учетом вышеописанных возможных проблем с увеличением длительности проведения закупочных процедур необходимо пересмотреть в сторону увеличения нормативы складских запасов лекарств, которые смогут обеспечить непрерывность лечебно-диагностического процесса в случае непредвиденных обстоятельств.
Финансовый ресурс
Вышеуказанный прирост численности работников требует увеличения фонда оплаты труда. Потребуются затраты на организацию новых рабочих мест, оснащенным специальным оборудованием, оптимизацию систем хранения, увеличение объемов складских запасов, а также на закупку или развитие информационных систем. Это существенные затраты для любой организации, их надо планировать и своевременно изыскивать.
Время
Временные затраты на администрирование всех этапов движения лекарственных препаратов также вырастут, этот фактор крайне важно заложить в систему управления производственными процессами.
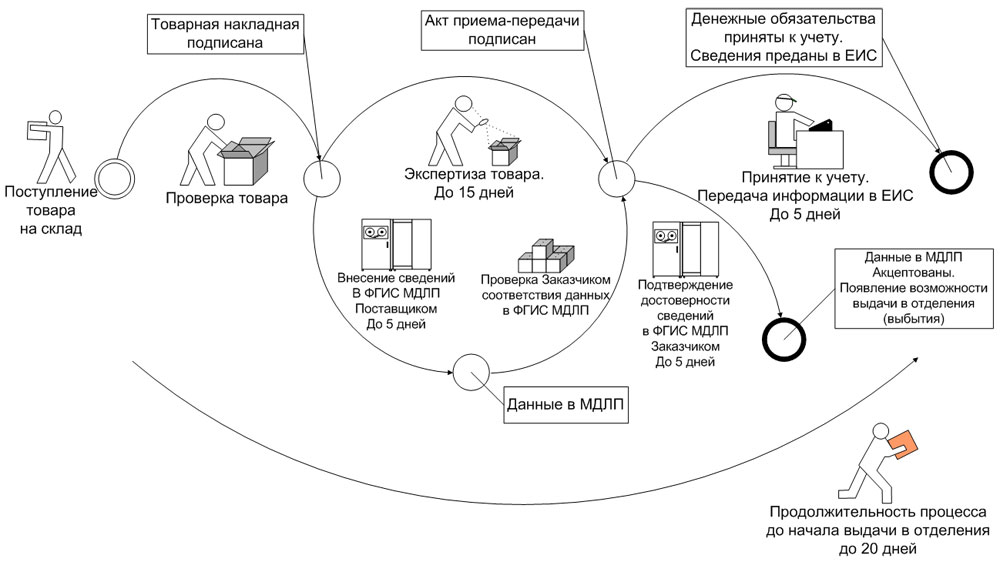
Одним из важнейших аспектов внедрения системы МДЛП для медицинского учреждения является необходимость перенастройки порядка взаимодействия с поставщиками лекарственных препаратов. В соответствии с п. 44 Положения о системе мониторинга движения лекарственных препаратов для медицинского применения, утвержденного Постановлением Правительства Российской Федерации от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» (далее — Положение) при передаче лекарственных препаратов между субъектами обращения внесение информации в ФГИС МДЛП может происходить двумя способами:
При этом решение о выборе типа порядка предоставления сведений принимается субъектами обращения лекарственных препаратов, предоставляющими данные сведения, самостоятельно. Это решение необходимо закрепить в контракте на поставку лекарственных препаратов.
Прямой порядок
В случае выбора прямого порядка предоставления сведений субъект обращения, осуществляющий передачу лекарственных препаратов другому субъекту обращения в рамках гражданско-правовых отношений (поставщик), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты отгрузки лекарственных препаратов предоставляет об этом в ФГИС МДЛП сведения, предусмотренные пунктом 2 приложения № 6 к Положению.
При этом субъект обращения, осуществляющий приемку лекарственных препаратов от другого субъекта обращения ЛП в рамках гражданско-правовых отношений (заказчик, медицинская организация), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки лекарственных препаратов и регистрации в ФГИС МДЛП сведений об отгруженных медикаментах, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о принимаемых лекарственных препаратах, предоставляя об этом сведения в ФГИС МДЛП, предусмотренных пунктом 4 приложения № 6 к Положению (рис. 1).
Рис. 1. Прямой способ внесения информации в ФГИС МДЛП
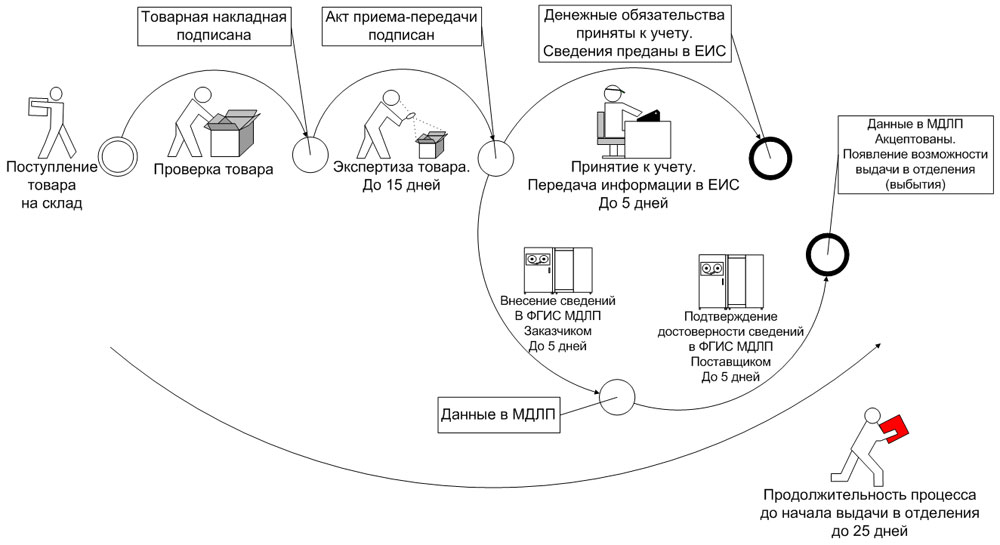
Обратный порядок
В случае выбора обратного порядка предоставления сведений субъект обращения, осуществляющий приемку медикамента от другого субъекта обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на ЛП, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки ЛП предоставляет в ФГИС МДЛП сведения о принятых ЛП, предусмотренные пунктом 3 приложения № 6 к Положению.
При этом субъект обращения, осуществивший передачу лекарства другому субъекту обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты регистрации в ФГИС МДЛП сведений о принятом товаре, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о переданных лекарственных препаратов, предоставляя об этом сведения в ФГИС МДЛП, предусмотренные пунктом 4 приложения № 6 к Положению (рис. 2).
Рис. 2. Обратный способ внесения информации в ФГИС МДЛП
В ходе подготовки к работе в новых условиях системы МДЛП важно учесть особенности медицинской организации в части её системы финансирования, организационной структуры, наличию удаленных (обособленных) подразделений, организации закупок лекарственных препаратов, в том числе участие в централизованных поставках и иные аспекты деятельности, обусловливающие многочисленные внутренние и внешние взаимосвязи, необходимые для бесперебойной работы системы лекарственного снабжения, и проводить внедрение новой системы в контексте данных качественного анализа деятельности организации.
* На заседании рабочей группы Росздравнадзора было принято решение о внесении изменений в Положение, предусматривающих сокращение сроков регистрации операций в ИС МДЛП по передаче лекарственных препаратов всеми участниками до 1 рабочего дня, в целях соблюдения приоритета интересов пациента и предоставления медицинской организации возможности выполнения требований законодательства в сфере охраны здоровья, обращения лекарственных препаратов и закупок (контрактной системы) без нарушений.
Источник