- Как вылечить молочницу у женщин
- Как вылечить молочницу у женщин
- Как вылечить молочницу у женщин?
- Возбудитель
- Какие состояния способствуют развитию кандидоза?
- Классификация
- Патогенез:
- Взаимодействие с другими микроорганизмами
- Клиническая картина
- Диагностика
- Лечение кандидоза
- 1 этап
- Для лечения УК применяют препараты имидазала:
- Противогрибковые антибиотики:
- 2 этап
- 3 этап
- 4 этап
- Лечение кандидоза при беременности:
- КАНДИДОЗ ПИЩЕВОДА
Как вылечить молочницу у женщин
Как вылечить молочницу у женщин
Молочница (по научному генитальный кандидоз) — это заболевание слизистых оболочек половых органов, которое вызывается дрожжеподобными грибками.
Молочницей кандидоз называют потому, что заболевание сопровождается патологическими выделениями из половых путей, напоминающими творог.
Кандидоз как заболевание слизистых и кожи представляет большую проблему для врачей всех специальностей.
Генитальный кандидоз это заболевание, которое часто носит хронический, рецидивирующий характер, часто сопровождает беременность, бывает связано с менструальным циклом.
Как вылечить молочницу у женщин?
В рекламе пимафуцина, одного из препаратов для лечения кандидоза вы услышите такие слова: «Три дня использования пимафуцина и прощай молочница!» На практике же оказывается так, что пимафуцином вы пролечитесь, но придет очередная менструация и все (рецидив молочницы) повториться сначала. В чем же здесь дело? Что препараты не работают или их неправильно применяют?
Дело здесь совсем в другом. Хочу сразу оговориться, что я не имею ничего против пимафуцина. Это хороший препарат для лечения кандидоза. Только для того чтобы понимать, почему это заболевание длительно течет и рецидивирует, нужно знать особенности возбудителя.
Возбудитель
Кандидоз вызывается дрожжеподобными грибками рода Candida в 90% случаев, реже встречаются другие грибки рода Torulopsis в чистой культуре или в ассоциации с Candida albicans.
Грибы рода Candida это аэробы, т.е. живут в присутствии кислорода. Грибковая флора это сапрофит на коже и слизистых оболочках рта, кишечника, половой системы человека. Очень часто грибковая флора обнаруживается у практически здоровых беременных и небеременных женщин без признаков кандидозного кольпита.
Сапрофиты это такие микроорганизмы, которые живут за счет питательных веществ окружающей среды, не вызывают клиники заболевания при нормальных условиях, но если у человека снижается иммунитет или возникает другие благоприятные условия, такие микроорганизмы приобретают патогенные свойства и начинают вызывать заболевания.
В половые пути женщины грибки могут попадать из кишечника, при половых контактах. Но половой путь передачи не является основным, т.к. развитию заболевания способствую самые разнообразные факторы. Споры грибов Candida имеют округлую форму, при активном воспалительном процессе образуют цепочки псевдомицелия. Клетки размножаются путем почкования.
Какие состояния способствуют развитию кандидоза?
- гормональные нарушения
- нарушения обмена веществ
- сахарный дибет
- туберкулез
- прием цитостатиков
- прием антибиотиков
- прием глюкортикоидов
- прием иммунодепрессандов
- прием пероральных контрацептивов
- хронические колиты, гастриты
- дефицит витаминов группы В
- беременность
- ВИЧ инфекция
- гепатиты
- у женщин с хроническими воспалительными процессами половых путей
- хронические воспалительные процессы мочевыделительной системы.
Все эти состояния или их сочетания приводят к развитию патогенных свойств грибковой флоры и клиническим проявлениям кандидоза, при чем не только генитального. Надеюсь, что теперь стало понятным, почему пимафуцин при всей его эффективности не приводит к полному излечению от заболевания. Потому что если из организма не убираются условия для активации патогенных свойств возбудителя, то заболевание будет постоянно рецидивировать.
И лечение такой патологии нужно начинать не местно, а системно с выявления всех факторов, которые поддерживают этот процесс. Теперь становиться понятным низкая эффективность лечения кандидоза при беременности, которая сопровождается иммунодефицитом (иначе выносить ребенка просто невозможно, т.к. его отторгнет организм матери).
Кандидоз развивается у женщин всех возрастных групп: в пубертате, в репродуктивном, в постменопаузе, только причины способствующие поддержанию такого состояния могут быть разными. У новорожденных – это результат инфицирования при прохождении по родовым путям.
У детей это дефицит эстрогенов (их еще нет), которые повышают устойчивость к инфекции и способствуют развитию нормальной влагалищной флоры. В репродуктивном возрасте кандидоз чаще развивается на фоне хронических воспалительных процессов гениталий, во время беременности и при наличии сопутствующей патологии. В постменопаузальном периоде – кандидозу способствуют нарушения обмена веществ, сахарный диабет, дефицит все тех же эстрогенов, но уже на фоне снижения гормональной функции яичников, наличие хронических колитов, гастритов и т.д. Частота встречаемости кандидоза по России 185 на 100 тыс населения.
Классификация
В настоящее время нет единой классификации кандидоза. Целесообразно различать кандидоз:
- острый
- хронический
- кандидоносительство
Далее указывается полный топический диагноз.
Патогенез:
Кандидоз – это воспаление слизистой оболочки влагалища, шейки матки, наружных половых органов.
Воспалительный процесс возникает на фоне снижения иммунитета, что вызывает развитие патогенных свойств грибковых клеток. Они начинают внедряться в слизистые оболочки хозяина, вызывают зуд, жжение, воспалительную реакцию.
При тяжелых воспалениях проникновение возбудителя бывает очень глубоким вплоть до мышечного слоя и распространения инфекции по всему организму. Наличие грибковой инфекции вызывает сильную аллергию. Достаточно часто при хронических кандидозах даже употребление в пищу дрожжевого теста, сахара или пива может вызывать зуд на местах кандидозных поражений.
Взаимодействие с другими микроорганизмами
Лактобактерии – нормальная влагалищная флора подавляют рост грибов. Возможно существование возбудителя кандидоза с другими микроорганизмами, например, с вирусами, гонококками и др.
Клиническая картина
Клинические проявления – это зуд, жжение, патологические выделения – бели жидкие, творожистые, белого или серого цвета с кислым неприятным запахом.
При попадании инфекции в мочевые пути возникает зуд, жжение, рези при мочеиспускании.
Зуд сопровождается бессонницей, что приводит к нервно-психическим нарушениям.
Классическим проявлением заболевания являются налеты белого или серого цвета на воспалительно измененных слизистых оболочках половых путей. Налеты эти можно удалить тампоном, под ними часто можно видеть легко кровоточащую поверхность.
Эти налеты состоят из псевдомицелия грибка, слущенного эпителия и лейкоцитов. Слизистая оболочка в острую стадию гиперемированная отечная. В хронической стадии и при кандидоносительстве воспалительных изменений может и не быть. Течение заболевания длительное (месяцы, годы), рецидивирующее, трудно поддающееся лечению. Часто устанавливается зависимость от фаз менструального цикла или от обострения сопутствующей патологии.
Диагностика
Диагностика чаще всего не представляет затруднений.
Заподозрить заболевание позволяют характерные симптомы — зуд, бели, характерные налеты. Для подтверждения диагноза используют микроскопию мазков, окрашенных по Граму. Применяют также ПЦР (полимеразно-цепная реакция) для выявления ДНК возбудителя.
Культуральный метод – посевы на питательную среду.
Используются также серологическая диагностика, аллергическая кожная проба.Диагностика также должна включать в себя распознавание всех состояний, которые могут приводить к рецидиву заболевания.
Внимание! Обнаружение в мазках или моче спор дрожжеподобных грибов при отсутствии клинических симптомов не является показанием для назначения лечения, т.к. они периодически могут выделяться и у здоровых людей.
Лечение кандидоза
Лечение должно проводиться системно, совместно с половым партнером. Хотя половой путь не является основным, но эффективность лечения повышается при санации полового партнера. При лечении рекомендуется половое воздержание или барьерная контрацепция.
1 этап
Включает в себя противогрибковое лечение общее и местное с использованием специальных антибиотиков
Для лечения УК применяют препараты имидазала:
- гино-травоген,
- травоген,
- клотримазол,
- миконазол,
- эконазол.
Противогрибковые антибиотики:
- натамицин (пимафуцин),
- нистатин,
- леворин,
- амфотерицин.
2 этап
Восстановление нормальной влагалищной рН среды и флоры с использованием лактобактерина, бифидумбактерина, молочной кислоты и др. препаратов.
3 этап
При наличии аллергии и других соматических проявлений используются антигистаминные препараты, витамины группы В, диета, богатая витаминами, препараты нормализующие функцию желудка, кишечника, печени. Ограничение на время лечения приема алкоголя, пива, сладкого, мучного, содержащего дрожжи.
4 этап
Восстановление нормального гормонального фона, лечение сопутствующей гинекологической патологии.
Лечение кандидоза при беременности:
Проводят по тем же принципам. Возможно лечение кандидоза на протяжении всей беременности. Целесообразно использовать местное лечение (санация влагалища) непосредственно пред родами для профилактики разрывов влагалища и кандидоза новорожденного.
Источник
КАНДИДОЗ ПИЩЕВОДА
Кандидоз — инфекционное заболевание слизистых оболочек, кожи и внутренних органов, вызванное дрожжеподобными грибами рода Candida . Кандидоз пищевода (КП), являющийся проявлением висцерального кандидоза, занимает видное место среди инфекционных поражени
Кандидоз — инфекционное заболевание слизистых оболочек, кожи и внутренних органов, вызванное дрожжеподобными грибами рода Candida. Кандидоз пищевода (КП), являющийся проявлением висцерального кандидоза, занимает видное место среди инфекционных поражений пищевода. В последние годы прослеживается тенденция нарастания частоты КП, особенно у пациентов с нарушением иммунитета. Рост кандидозной инфекции в значительной степени обусловлен увеличением количества больных с ВИЧ-инфекцией, успехами в трансплантологии и иммуносупрессивной терапии, бесконтрольным использованием антибиотиков. КП встречается у 0,7-1,5% больных гастроэнтерологического профиля [5, 6].
Проблема тяжелых грибковых инфекций, вызываемых оппортунистическими патогенами, состоит в том, что они трудно поддаются лечению и могут приводить к летальному исходу. Было обнаружено, что смертность при инвазивных кандидозных инфекциях составляет 34% [16].
Этиопатогенез. Различные виды Candida представляют собой наиболее часто встречающийся пищеводный патоген, прежде всего это касается Candida albicans, иногда встречаются C. tropicalis, C. parapsilosis, C. glabrata, C. lusitania и C. krusei. Эти микроорганизмы являются нормальными компонентами оральной флоры, и их рост сдерживается бактериальными комменсалами. Заражение грибами типа Candida, которые широко распространены в окружающей среде, происходит эндогенным или экзогенным путем. Эндогенное заражение связано с активированием грибов-сапрофитов; экзогенное инфицирование может произойти при прямом контакте с носителями инфекции или из окружающей среды. Если организм хозяина не ослаблен, многие грибы не проявляют своих патогенных свойств. Исследования последних лет показали, что источником диссеминации грибов служит кишечник, а кандидоз полости рта, гениталий, пищевода является проявлением системного кандидоза. Вероятность развития системного поражения зависит как от свойств самого микроорганизма (их количества, вирулентности, генетической и видовой неоднородности популяции), так и от состояния макроорганизма, особенно его иммунной системы, алиментарного статуса и абдоминального кровотока [3, 17].
Благоприятные условия для развития инфекционного процесса создают различные нарушения физиологических, анатомических и иммунологических механизмов защиты организма. В качестве факторов, провоцирующих возникновение эзофагеального кандидоза, можно назвать использование антибиотиков, ингаляционных или инъекционных кортикостероидов, антацидную терапию или гипохлоргидрическое состояние, сахарный диабет, алкоголизм, последствия интоксикации, недоедание, пожилой возраст, нарушение моторики пищевода или пищеводную обструкцию, трансплантацию органов и костного мозга, энтеральное и особенно парентеральное питание и др. Ослабление иммунной системы может привести к возникновению кандидозной инфекции. При сахарном диабете повышенный уровень глюкозы в крови способствует росту грибов, так как гипергликемия ослабляет функцию гранулоцитов. Гипофункция паращитовидных желез и надпочечников приводит к нарушению кальциево-фосфорного обмена, что вызывает скрытую спазмофилию пищевода, тем самым снижая его местные защитные возможности [9]. Нарушения нутритивного статуса из-за недостатка белка в организме и низкой калорийности пищи влияют на состояние иммунной системы и создают предпосылки для развития кандидоза [3]. К факторам риска заболевания кандидозом относится снижение кислотности желудочного сока (рН 7,4 является оптимальной для роста грибов Candida, а при сдвиге рН до 4,5 рост грибов полностью угнетается) [3, 4, 7].
Патологические проявления КП разнообразны. Сначала пораженные участки пищевода имеют вид отдельных беловатых или желтоватых очажков, приподнятых над слизистой оболочкой. Позднее эти очажки могут сливаться, образуя плотные налеты с внедрением гриба в подслизистую оболочку или псевдомембранозные наложения с проникновением гриба в мышечную оболочку и сосуды [9]. Пленки, образующиеся на слизистой пищевода в особенно тяжелых случаях, могут почти полностью закрывать просвет пищевода. Налет состоит из слущенных эпителиальных клеток, которые смешиваются с грибками, клетками воспаления и бактериями. Микроскопическое исследование позволяет выявить равномерно окрашенные дрожжеподобные клетки и нити мицелия грибов Candida [9]. Истинное язвообразование наблюдается нечасто и в большинстве случаев отмечается у иммуносупрессированных больных с гранулоцитопенией [29]. Иногда возникает некроз стенки пищевода и развивается флегмонозное воспаление пищевода и средостения, что может стать одной из причин смерти больного [1].
Существует морфологическая классификация, согласно которой все случаи КП подразделяются на три группы в зависимости от степени тяжести процесса, то есть в зависимости от глубины поражения его стенки: 1-я группа — отдельные беловатые налеты с внедрением псевдомицелия гриба между эпителиальными клетками; 2-я группа — пленчатые налеты, сливающиеся между собой и образующие обширные поля, при этом нити псевдомицелия прорастают не только слизистую, но и подслизистую оболочку; 3-я группа — псевдомембранозные наложения, сочетающиеся с глубокими изменениями, при которых нити гриба глубоко проникают в толщу мышечной ткани [10].
Клинические проявления и осложнения. Симптомы заболевания практически отсутствуют у 25-30% пациентов, страдающих КП, особенно у иммунокомпетентных лиц. Тем не менее большинство пациентов предъявляют жалобы, связанные с поражением желудочно-кишечного тракта. Наиболее типичные клинические проявления КП — дисфагия и несколько реже одинофагия. Степень выраженности пищеводных симптомов колеблется от умеренного затруднения при глотании до резко выраженной боли, результатом чего являются неспособность принимать пищу и развитие вторичной дегидратации. При тяжелой одинофагии возможно наличие других причин или коинфекции, особенно у больных со СПИДом. Гораздо реже больные могут жаловаться на загрудинные боли, не связанные с глотанием, изжогу, тошноту, иногда рвоту с выделением пленок (псевдомембран), снижение аппетита и веса, появление жидкого стула со слизью (см. рисунок) [4, 9, 29].
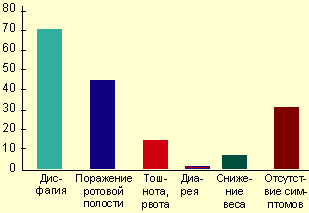 |
| Симптомы кандиозного эзофагита (R. S. Orlando, 1996) |
При КП может быть полезно физикальное исследование. Приблизительно две трети пациентов со
СПИДом и пищеводным кандидозом имеют кандидозный стоматит. КП наблюдается у больных с хроническим слизисто-кожным кандидозом, который относится к тяжелым формам кандидозной инфекции и чаще наблюдается при дисфункции надпочечников и околощитовидных желез [29].
Осложнения пищеводного кандидоза наблюдаются редко. Эзофагеальное кровотечение может наблюдаться при тяжелом течении болезни, сопровождающемся образованием эрозий, язв, и ассоциироваться с коагулопатией; возможно развитие перфорации. Описана вторичная обструкция просвета мицетомой. Редко возникает некроз с развитием флегмонозного воспаления пищевода и средостения [1]. В тяжелых случаях специфический эзофагит может осложниться развитием кандидамикозного сепсиса [6].
Диагностика. Подозрение на пищеводный кандидоз должно возникнуть у любого больного при наличии факторов риска развития пищеводной инфекции и жалоб на дисфагию и одинофагию. Наличие кандидозного стоматита подтверждает этот диагноз, но при его отсутствии поражение пищевода также не исключается.
Рентгенография пищевода с использованием бария обычно применяется для начальной оценки перед проведением эндоскопии. Однако на ранних стадиях кандидозного эзофагита рентгенологическое исследование пищевода не имеет большого диагностического значения, так как оно отражает лишь неспецифические изменения, общие для всех эзофагитов [2]. Классическими рентгенологическими признаками острого эзофагита, вызванного Candida spp., являются линейные или неправильной формы дефекты наполнения с четкими краями. При тяжелом течении кандидозного эзофагита происходит слияние повреждений, из-за чего большие дефекты наполнения иногда образуют скопления в виде гроздьев винограда [2]. Пищевод при этом приобретает «косматый» («ворсистый») вид, симулируя ульцерацию [25]. Наличие больших, хорошо очерченных язв не является признаком кандидозного эзофагита. Могут наблюдаться нарушение моторики и сужение просвета пищевода за счет псевдомембран. Следует помнить о том, что нормальная рентгенограмма пищевода с использованием бария не исключает пищеводного кандидоза. Из-за тяжелой одинофагии больной не сможет выпить барий, что затрудняет рентгеногрфию пищевода [29].
Более информативным для диагностики кандидозного эзофагита считается рентгенологический метод двойного контрастирования, эффективность которого достигает 70% [26].
Цитологическая щетка и баллонный катетер используются для быстрой диагностики пищеводных инфекций без эндоскопии. Эти инструменты могут быть легко введены через носовые ходы или рот сквозь защитный зонд, который предотвращает контаминацию. Материал, полученный на защищенной щетке или баллонном катетере после того, как они будут изъяты из пищевода, оценивается цитологически и культурально. Методика с использованием защищенных щеток имеет чувствительность 88% и специфичность почти 100% [26].
Цитологический метод предполагает окраску мазков-отпечатков или осадка смыва с цитологической щетки в поисках активных форм Candida — почкующихся дрожжевых клеток, псевдомицелия и мицелия. Культуральный метод предполагает помещение исследуемого материала на обогащенную глюкозой среду Сабуро или другие среды, чтобы затем по характеру образующихся колоний судить об этиологии инфекционного процесса в пищеводе.
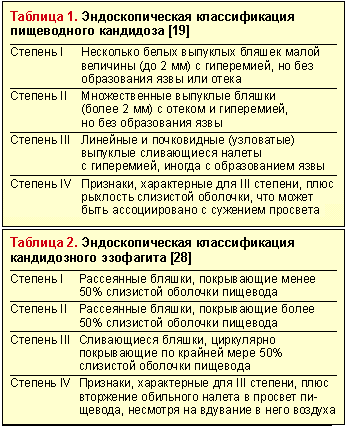
Эндоскопическое исследование пищевода — наиболее чувствительный и специфический метод диагностики пищеводного кандидоза. Эндоскопическая картина КП характеризуется чаще всего наличием легко снимающихся фибринозных рыхлых наложений белого или желтого цвета, под которыми обнаруживается легкоранимая и/или отечная слизистая. Реже наблюдаются катаральный и эрозивно-язвенный эзофагит [19]. Candida spp. редко вызывает истинное язвообразование. Наличие язвы при кандидозном эзофагите нередко служит признаком дополнительного патологического процесса в пищеводе [29]. Существуют различные эндоскопические классификации пищеводного кандидоза (табл. 1 и 2).
В ходе эндоскопии пораженные участки слизистой могут быть подвергнуты щеточной биопсии для цитологического исследования или биопсии для гистологической диагностики. Когда эндоскопически идентифицируются язвы, многократное проведение биопсии помогает исключить наличие сосуществующих патологических процессов. Цитологическое исследование материала, полученного с помощью браш-биопсии, имеет более высокую ступень чувствительности, чем гистологическое исследование образцов биопсии при умеренном поверхностном кандидозе, потому что микроорганизмы могут быть вымыты с поверхности ткани при обработке биопсийного материала [19]. В редких случаях позитивная цитология при наличии отрицательной гистологии указывает на то, что речь идет скорее о колонизации, чем об инфекции. При более тяжелом кандидозном поражении пищевода наибольшее диагностическое значение имеет гистологическое исследование биоптатов слизистой с использованием специальной окраски на нейтральные мукополисахариды по Шиффу PAS (ШИК-реакция) или по Gomori гексаметилентетрамином серебра. Только гистологическое исследование демонстрирует инвазию мицелия или псевдомицелия гриба в глубь ткани пищевода.
Кожное тестирование и серологические тесты малоинформативны для диагностики пищеводного кандидоза.
Лечение. Существует множество пероральных и внутривенных медикаментов, которые используются для лечения кандидозного эзофагита. Несмотря на относительно широкий выбор препаратов, лечение КП является актуальной проблемой, так как некоторые лекарственные средства недостаточно эффективны, другие имеют серьезные побочные эффекты; кроме того, в настоящее время отмечается рост резистентности к антигрибковым препаратам.
При лечении КП первоначально должна быть назначена пероральная терапия, внутривенное введение используется лишь в случае рефрактерного течения заболевания или если имеются противопоказания к пероральному использованию медикаментов. Больным с умеренной степенью тяжести заболевания и минимальным нарушением иммунитета необходим сокращенный курс терапии с использованием системных абсорбируемых лекарственных препаратов типа орального азола. Иммунокомпрометированных больных после трансплантации и больных СПИДом с КП лучше лечить более длинными курсами азола. У пациентов с гранулоцитопенией, когда имеется существенный риск диссеминации Candida инфекции, оправданно использование внутривенных препаратов системного действия (азолов, амфотерицина B) [29].
Арсенал современных противогрибковых средств достаточно широк. Для лечения пищеводного кандидоза используют антигрибковые препараты нескольких групп. Наиболее эффективны препараты из группы азола. Перорально используют невсасывающиеся азолы (клотримазол, миконазол); однако более эффективны препараты системного действия из этой группы (кетоконазол, флуконазол и итраконазол). Эти препараты, подобно другим из группы азола, изменяют проницаемость клеточной мембраны грибов посредством цитохром P450 (CYP)-зависимого вмешательства в биосинтез эргостерола, что приводит к повреждению грибной клетки и ее смерти. Новые триазолы (итраконазол и флуконазол) имеют большее аффинное подобие, чем имидазолы (миконазол и кетоконазол) для грибных CYP-энзимов [14]. Хотя другие средства, такие, как миконазол, клотримазол и нистатин, могут быть использованы для лечения кандидозного стоматита, а также для профилактики пищеводного поражения, эти лекарственные средства менее эффективны в качестве основной группы препаратов для терапии КП [24].
Клотримазол и миконазол — препараты имидазолового ряда. В настоящее время выпускаются клотримазол в таблетках и миконазол для перорального применения. Однако они не всасываются в желудочно-кишечном тракте. Эти препараты могут использоваться при легком кандидозном поражении пищевода у лиц без иммунодефицита.
Кетоконазол (низорал, ороназол) является производным имидазола и при ежедневном приеме в дозе от 200 до 400 мг дает хороший эффект в лечении пищеводного кандидоза. У больных СПИДом, которым обычно требуются более высокие дозы кетоконазола, дневная доза может быть увеличена, если не возникает тошноты, до максимальной (800 мг). Кетоконазол хорошо проникает в различные органы и ткани, но плохо — через гематоэнцефалический барьер. Препарат хорошо всасывается в желудочно-кишечном тракте, но для оптимального всасывания требуется кислая среда. При желудочной гипохлоргидрии и использовании антацидных средств его биодоступность уменьшается. Для улучшения всасывания кетоконазол следует принимать за 2 часа до приема противоязвенных препаратов. Приблизительно у 10-25% больных СПИДом наблюдается снижение желудочной кислотной секреции. Кетоконазол же может вызвать временную блокаду синтеза тестостерона и кортизола [6, 8, 29].
Итраконазол (споранокс) относится к группе триазолов, подобно кетоконазолу, назначается в дозе 200 мг в день. Дальнейшее увеличение дозы удлиняет период полураспада препарата и повышает его эффективность. Всасывание интраконазола уменьшается при снижении pH желудочного сока [23]. Кетоконазол и итраконазол метаболизируются в печени и выделяются с желчью. Период полураспада этих двух препаратов составляет от 7 до 10 часов и от 24 до 42 часов соответственно [14]. Коррекции дозы у больных с почечной недостаточностью не требуется.
Флуконазол (дифлюкан, дифлазон, форкан, флюкостат — отечественный флуконазол) представляет собой водорастворимый триазол и назначается в дозе 100 мг в день. Флуконазол — это препарат, всасывание которого не зависит от pH желудочного сока и который значительно более эффективен при лечении пищеводного кандидоза при СПИДе, чем кетоконазол (200 мг ежедневно) [21]. Флуконазол доступен для перорального и внутривенного применения. Он минимально метаболизируется и выделяется неизмененным с мочой. Флуконазол отличается высоким тканевым тропизмом и не влияет на синтез андрогенов, хорошо проникает через гематоэнцефалический барьер. В отличие от кетоконазола и интраконазола он хорошо растворим в воде и минимально связывается белком. Препарат обладает длительным периодом полураспада (приблизительно 30 часов, если не нарушена функция почек, а наличие пищи или гипохлоргидрия не изменяют всасывание), что позволяет принимать его один раз в сутки. Показано, что введение флуконазола улучшает иммунные показатели по Т- и В-системам [18]. И флуконазол, и итраконазол можно принимать перорально в виде растворов. Эти формы могут быть более эффективны, чем таблетки, потому как усиливают локальный эффект и улучшают всасывание.
Неблагоприятные воздействия кетоконазола, флуконазола и итраконазола прежде всего зависят от дозировки и проявляются в виде тошноты, гепатотоксичности, замедления продукции стероидов и метаболизма циклоспорина [14]. В редких случаях кетоконазол может вызывать фатальный гепатит [12]. Незначительное увеличение аминотрансфераз — общий побочный эффект для всех трех препаратов, однако это не должно служить оправданием для их отмены. Влияние на стероидогенез наиболее выражено у кетоконазола. Обратимое замедление гонадального и надпочечного синтеза стероидов под воздействием кетоконазола может наблюдаться, когда доза превышает 400 мг в сутки [27]. В рекомендуемых дозах флуконазол и итраконазол не влияют на стероидогенез. В результате воздействия на печеночные микросомальные ферменты все три азола ингибируют метаболизм циклоспорина, что приводит к увеличению уровня циклоспорина в крови; этот эффект наиболее ярко выражен у кетоконазола [14].
Другая основная группа противогрибковых средств — антибиотики полиены, представленные амфотерицином и нистатином. Эти препараты необратимо связываются со стеролами в грибковых клеточных мембранах, тем самым изменяя свойства проницаемости мембраны, нарушая ее барьерную функцию и вызывая клеточную смерть. Нистатин (антикандин, микостатин, фунгицидин) практически не всасывается в желудочно-кишечном тракте. Он используется для лечения кандидозного стоматита, но менее эффективен при поражении пищевода. Кроме того, эффективность, безопасность и легкость применения производных азола позволяют рассматривать нистатин в качестве средства терапии второго ряда. Амфотерицин В (амфостат, фунгизон) — единственный полиеновый антибиотик для парентерального введения. Он не всасывается в желудочно-кишечном тракте, применяется внутривенно капельно, хорошо проникает в различные органы и ткани, выделяется из организма почками. Период полувыведения составляет 24-48 часов, однако при систематическом применении может возрастать до 15 дней вследствие кумуляции в тканях [8]. Хотя амфотерицин B является наиболее эффективным препаратом, использующимся для лечения системных микозов, но из-за серьезных побочных эффектов его применение в лечении КП ограничено. Среди побочных эффектов амфотерицина можно выделить нейротоксичность, гематоксичность, нефротоксичность, местно-раздражающее действие (флебиты), аллергические реакции, диспептические расстройства, лихорадку и др. [8]. Наиболее неблагоприятным побочным эффектом, возникающим вследствие длительного использования амфотерицина, является нефротоксичность, которая обычно обратима. Этот препарат теперь доступен в виде раствора для перорального применения и пастилок. У больных с КП, которые резистентны к лечению флуконазолом или другими азолами, эффективными могут быть низкие дозы амфотерицина B, вводимого внутривенно (от 10 до 20 мг в день). Общая доза препарата для лечения пищеводного кандидоза составляет от 100 до 200 мг [29].
Флуцитозин — препарат с узким спектром противогрибковой активности, который действует благодаря вмешательству в трансляцию РНК. Он включается в клетки гриба, где превращается в 5-фторурацил и ингибирует тимидилат-синтетазу. Этот пероральный препарат, который назначается в дозе от 50 до 150 мг/кг в день каждые 6 часов, может быть использован в комбинации с амфотерицином B, но он не должен применяться в качестве монотерапии, потому что грибы быстро становятся к нему резистентными. Кроме того, монотерапия флуцитозином оказывается лишь умеренно эффективной [12].
Новейшим классом противогрибковых препаратов являются кандины, вмешивающиеся в синтез грибковой стенки. Они эффективны в отношении большинства видов Candida, в том числе C. krusei. Первые исследования показали, что капсофунгин, представляющий эту группу препаратов, оказался столь же эффективен при КП, как и амфотерицин В [16].
При лечении больных КП следует учитывать наличие резистентности, которая из-за широкого применения азолов в настоящее время значительно возросла. При развитии резистентности часто бывает полезно увеличить дозу азола. Если этого оказывается недостаточно, переходят на другой препарат из этой группы или используют пероральный раствор итраконазола [13], который нужно назначать в более высоких дозах из-за часто наблюдающейся перекрестной резистентности. Когда высокой дозы (то есть 400 мг ежедневно) флуконазола недостаточно, переходят на внутривенное введение амфотерицина B, при этом результат достигается в 90% случаев. Резистентность к амфотерицину наблюдается редко [29].
В табл. 3 представлено лечение кандидозного эзофагита в зависимости от функции лимфоцитов и гранулоцитов.
При лечении кандидозного эзофагита у больных СПИДом препаратами первого ряда являются кетоконазол и флюконазол, причем предпочтение следует отдавать флюконазолу. Из-за лучшей переносимости он прежде всего показан пациентам, находящимся на поздней стадии болезни, которые имеют много сопутствующих заболеваний. При нарушении глотания могут применяться парентеральные формы флуконазола. При неэффективности препаратов первого ряда используют лекарственные средства из группы резерва (амфотерицин В, итраконазол), которые более токсичные и/или более дорогие. Этиотропная терапия кандидоза пищевода, кроме основного курса лечения, требует проведения поддерживающего лечения, которое может быть пожизненным (табл. 4) [4].
Лечение кандидоза на фоне тяжелого иммунодефицита и лейкопении — задача сложная. Наряду с антигрибковой терапией актуально восстановление пула нейтрофильных лейкоцитов и их функциональной активности, так как нейтрофильные лейкоциты являются одним из основных звеньев механизма защиты от Candida spp. Предлагается в качестве дополнительного средства при лечении кандидозной инфекции на фоне нейтропении использовать гранулоцитарный колониестимулирующий фактор, который сокращает дефицит миелопероксидазы в нейтрофильных лейкоцитах и усиливает их кислородозависимую антикандидозную активность [7]. Получен хороший эффект от эндоскопического введения больным КП концентрата гранулоцитов и высокоинтенсивного импульсного лазерного излучения, что улучшает иммунные функции [5].
Таким образом, для достижения успеха у больных с тяжелыми грибковыми инфекциями, в том числе с кандидозом, целесообразен комплексный подход к диагностике и лечению. Повышению выживаемости будет способствовать оперативная диагностика с последующими подбором эффективной специфической противогрибковой терапии и проведением лечебных мероприятий, направленных на повышение числа гранулоцитов и стимуляцию фагоцитоза [16].
По вопросам литературы обращайтесь в редакцию
Источник