- Что такое элиминация лекарственного вещества
- Лекция 3 элиминация лекарственных средств
- Биотрансформация лекарственных средств
- Элиминация лекарств
- Биотрансформация лекарств. Несинтетические и синтетические реакции метаболизма.
- Таблетка с двойным дном
- Где действующее вещество, Лебовски?
- Технологии модифицированной доставки
- Типы модифицированного высвобождения
- Модифицированные формы: день сегодняшний
Что такое элиминация лекарственного вещества
Морфологические барьеры организма проиллюстрированы в предыдущей статье на сайте. Физико-химические свойства лекарственного средства определяют, достигнет ли он цели, расположенной на поверхности или внутри клеток организма либо бактериальных клеток, и в какой степени.
В тех случаях, когда препарат принимается внутрь или вводится парентерально, фармакокинетические процессы идут совершенно иначе, чем при местном применении.
Это становится очевидным, если проследить путь принятого внутрь препарата, начинаяс места всасывания до попадания в кровоток. Возможен один из следующих вариантов развития событий.
1. Препарат проникает через эпителий кишечника в энтероциты, однако Р-гликопротеид транспортирует его обратно в просвет кишечника. Поэтому итоговое всосавшееся количество препарата может быть значительно меньше.
Этот «противотранспорт» различен у разных людей в отношении одного и того же вещества и, кроме того, подвержен влиянию других лекарственных средств.
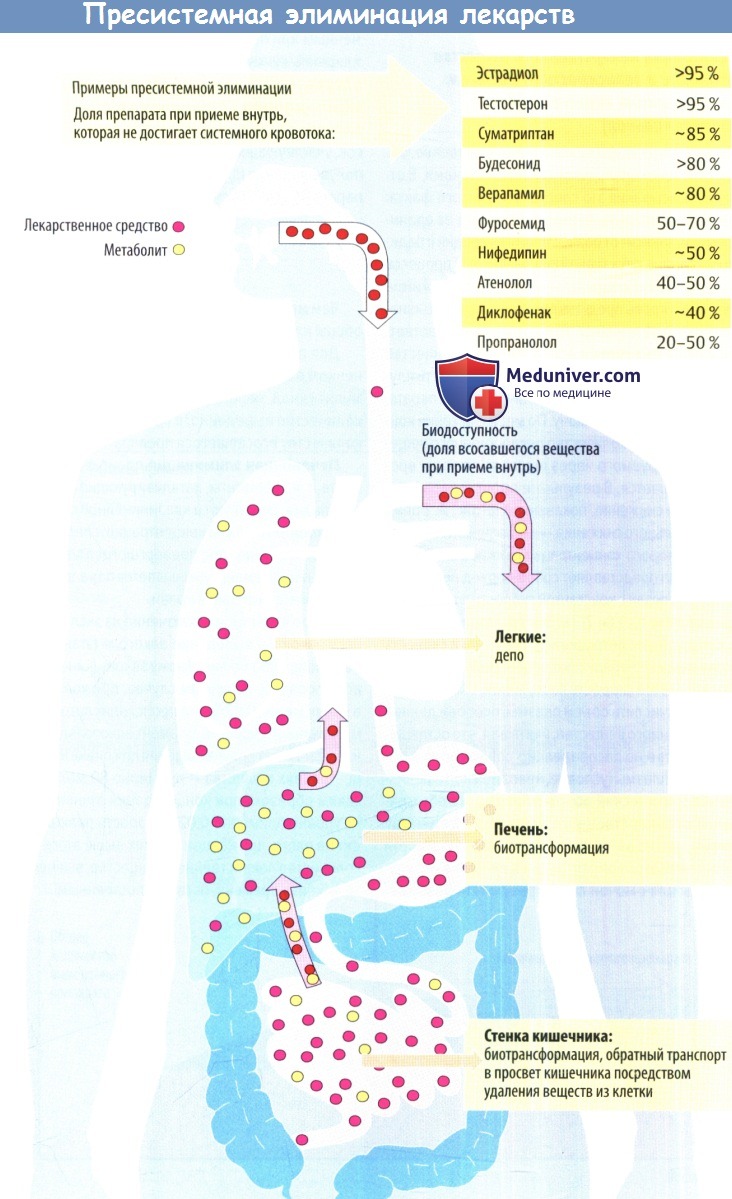
2. На пути из просвета кишечника в общее циркуляторное русло принятый внутрь препарат расщепляется под воздействием ферментов, например цитохромоксидазы Р450.
(а) Разрушение может начаться уже в слизистой кишечника. Другие лекарственные средства или химические вещества могут подавлять или стимулировать активность изоферментов цитохрома в кишечнике.
Отдельный пример — сок грейпфрута, который подавляет активность оксидаз CYP3A4 в стенке кишечника и вызывает повышение в крови концентрации некоторых лекарственных средств до токсического уровня.
(б) Самую важную роль играет метаболизм в печени, которому подвергается любое лекарственное средство, попадающее в организм. В печени работает множество ферментов, химически преобразующих эндогенные и экзогенные вещества, чтобы обеспечить их выведение из организма. Только часть всосавшегося количества может попасть в кровь печеночной вены, это зависит от количества препарата, поглощенного и переработанного гепатоцитами.
Следует учитывать, что другие препараты могут вызывать повышение активности ферментов (увеличение гЭР).
Процессы, о которых говорится выше, объединены термином «пресистемная элиминация».
3. Парентеральное введение лекарственного вещества позволяет обойти пресистемную элиминацию. При в/в, п/к и в/м введении препарат проходит через полую вену, попадает в правый желудочек и, через легкие, в левый желудочек, далее — в системный кровоток.
Богатые жиром и имеющие большую поверхность легкие всасывают некоторое количество липофильных и амфифильных веществ, а затем медленно выделяют их после снижения концентрации в крови.
Во время быстрого поступления лекарственного средства в организм легкие играют роль буфера и защищают сердце от избыточной концентрации веществ после в/в введения.
В некоторых ситуациях желательна быстрая пресистемная элиминация. Яркий пример — назначение глюкокортикоидов при бронхиальной астме.
Поскольку большая часть ингалированного препарата обычно проглатывается, глюкокортикоиды с полной пресистемной элиминацией оказывают минимальную системную нагрузку на организм.
Использование клопидогрела для ингибирования агрегации тромбоцитов — пример желательной пресистемной активации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Лекция 3 элиминация лекарственных средств
Элиминация (лат. elimimo, elimmatum — выносить за порог, удалять) представляет собой удаление лекарственных средств из организма в результате биотрансформации и экскреции.
Лекарственные средства элиминируются только из центральной камеры. Лекарства, находящиеся в периферической камере, предварительно транспортируются в центральную камеру, а затем подвергаются элиминации.
Элиминация лекарственных средств из плазмы крови происходит согласно экспоненциальной кинетике первого порядка — выводится постоянная часть от концентрации за единицу времени. При работе систем элиминации в условиях насыщения возникает кинетика нулевого порядка — выводится постоянное количество препарата за единицу времени.
Элиминацию лекарственных средств характеризует ряд фармакокинетических параметров:
• Константа скорости элиминации — часть от концентрации в крови, удаляемая за единицу времени (вычисляется в %);
• Период полуэлиминации — время, за которое концентрация в крови снижается наполовину (Т1/2);
• Клиренс (англ. clearance — очищение) — объем жидких сред организма, освобождающихся от лекарств в результате их биотрансформации, выведения с желчью и мочой (вычисляется в мл/мин’кг).
Различают печеночный (метаболический, желчный) и почечный клиренсы. Например, у циметидина — противогистаминного средства, применяемого для терапии язвенной болезни, почечный клиренс равен 600 мл/мин, метаболический — 200 мл/мин, желчный — 10 мл/мин. Клиренс зависит от состояния ферментных систем печени и итенсивности печеночного кровотока. Для элиминации препарата с быстрым метаболизмом в печени — местного анестетика лидокаина основное значение имеет печеночный кровоток, для элиминации антипсихоти-ческих средств группы фенотиазина — активность ферментных систем детокси-кации.
При повторном применении лекарственных средств в биофазе циторецепторов создается равновесное состояние, когда количество поступающего препарата равно количеству элиминируемого. При равновесном состоянии концентрация колеблется в небольших пределах, а фармакологические эффекты проявляются в полной мере. Чем короче период полуэлиминации, тем скорее достигается равновесная концентрация, и тем больше разница между максимальной и минимальной концентрациями. Обычно равновесное состояние наступает через 3-5 периодов полуэлиминации.
Биотрансформация лекарственных средств
Биотрансформация представляет собой метаболические превращения лекарственных средств. В большинстве реакций образуются метаболиты, более полярные, чем исходные лекарственные средства. Полярные метаболиты хуже растворяются в липидах, но обладают высокой растворимостью в воде, меньше подвергаются энтерогепатической циркуляции (выведение с желчью в кишечник и повторное всасывание в кровь) и реабсорбции в почечных канальцах. Без биотрансформации одна терапевтическая доза снотворного средства этаминала могла бы находиться в организме 100 лет.
Эндобиотики подвергаются превращениям под влиянием специфических ферментов, осуществляющих метаболизм их эндогенных аналогов. Ксенобиотики используют для метаболизма ферменты с малой субстратной специфичностью, например, окисляются при участии ци-тохрома Р-450, созданного в эволюции 3,5 миллиарда лет тому назад для инактивации стероидов.
Биотрансформация ксенобиотиков происходит в печени (90-95%), слизистой оболочке тонкого кишечника, почках, легких, коже, крови. Наиболее изучены процессы биотрансформации на мембранах гладкого эндоплазматического ретикулума (ЭПР) печени. При гомогенизации и ультрацентрифугировании клеток канальцы ЭПР разрываются и превращаются в функционально активные фрагменты — микросомы. Реакции биотрансформации протекают также в ядре, цитозоле, митохондриях, плазматической мембране.
Процессы биотрансформации разделяют на 2 фазы. В реакциях первой фазы — метаболической трансформации молекулы лекарственных средств подвергаются окислению, восстановлению или гидролизу. Большинство лекарств преобразуется в неактивные метаболиты, но также могут появляться активные и токсические производные (табл. 3.1). Во второй фазе — реакциях конъюгации лекарственные средства присоединяют ковалентной связью полярные фрагменты с образованием неактивных продуктов. Для реакций конъюгации необходима затрата энергии.
Активные метаболиты лекарственных средств
Источник
Элиминация лекарств
Элиминацией лекарств (лат.elimino– выносить за порог) – называют совокупность процессов метаболизма и выведения, которые способствуют удалению активной формы лекарства из организма и снижению его концентрации в плазме крови. Элиминация включает в себя 2 процесса: биотрансформацию (метаболизм) и экскрецию лекарств. Основными органами элиминации являются печень и почки. В печени элиминация протекает путем биотрансформации, а в почках – путем экскреции.
Биотрансформация лекарств. Несинтетические и синтетические реакции метаболизма.
Биотрансформацией (метаболизмом) называют изменение структуры лекарств в результате их химической модификации. Основная направленность процессов метаболизма – перевод лекарств в гидрофильную форму, которая лишена фармакологической активности и способна легко выводиться из организма.
Метаболизм лекарств включает 2 фазы:
I фаза – несинтетические реакции метаболизма.К этой фазе относят окисление, восстановление или гидролиз молекул лекарства. Основная направленность реакций этого типа – лишить ксенобиотик активности.
Восстановление.Реакции восстановления характерны для:
К
Нитроредукции ароматических соединений, содержащих нитрогруппу. Данный вид реакций протекает в печени и кишечнике. Таким образом происходит метаболизм метронидазола. R-NO2¦R-NH2
Гидролиз.Наиболее характерен для сложных эфиров и замещенных амидов. Протекает в стенке кишечника, печени и крови. Функцию гидролиза эфиров в крови чаще всего осуществляет фермент псевдохолинэстераза (бутирилхолинэстераза), который имеет низкую субстратную специфичность и может гидролизовать любую эфирную связь.
Путем гидролиза протекает метаболизм эналаприла, тестостерона пропионата (эфирный гидролиз), лидокаина (амидный гидролиз).
Окисление.Окисление биологических субстратов – универсальный механизм инактивации ксенобиотиков, который обеспечивают микросомальные ферменты печени. Это группа липофильных белков, сосредоточенная в мембранах эндоплазматического ретикулума гепатоцитов. Основой микросомальной системы ферментов являются 2 энзима: флавопротеин-НАДФ·Н-зависимая цитохром Р450редуктаза и гемопротеин цитохром Р450.
Схема 6. Цикл микросомального окисления. Пояснения в тексте. Л – лекарственное вещество.
Первоначально, окисленный Р450присоединяет лекарственное вещество. Затем, комплекс цитохром-лекарство восстанавливается НАДФ·Н-зависимой редуктазой и присоединяет кислород. Для активации молекулы кислорода НАДФ·Н-зависимая редуктаза повторяет цикл восстановления. На финальном этапе, один из атомов кислорода включается в молекулу воды, а второй – в лекарственное вещество, после чего цитохром регенерирует в исходное состояние.
Цитохром Р450является не 1 ферментом, а суперсемейством из более чем 300 изоформ, способных катализировать около 60 типов окислительных реакций, с сотнями потенциальных субстратов. Фактически, цитохромы способны обеспечить окисление не только всех существующих в настоящее время молекул лекарств, но и все лекарства, которые когда-либо еще будут синтезированы.
Молекулы цитохрома Р450, которые функционируют в клетках человека могут быть объединены в 17 семейств:CYP1-CYP17. Наибольшую роль в метаболизме лекарств играют первые 3 семействаCYP1-CYP3 (из них изоформыCYP3A4/3A5 иCYP2D6 метаболизируют 75% всех лекарств).
II фаза – синтетические реакции метаболизма.Как правило, эти реакции протекают только после того, как завершиться фазаI. Синтетические реакции метаболизма призваны повысить гидрофильность ксенобиотика. Все реакции этой группы могут быть разделены на 2 вида:
Реакции, в которых активируется конъюгирующее вещество:
Источник
Таблетка с двойным дном
Изучаем лекарственные формы с модифицированным высвобождением — от пеллетов профессора Лебовски до современных систем coat-core
Фармация — отрасль постоянно развивающаяся, ищущая новые формулы и формы. Создание принципиально новых лекарственных субстанций сопряжено с огромными временными и материальными затратами. В среднем вывод на рынок нового препарата занимает 12–14 лет, а доля потенциально эффективных молекул в общей массе составляет 1:10 000 [1]. Есть и второй путь развития — использование хорошо известных субстанций в новых лекарственных формах с повышенной эффективностью, улучшенной биодоступностью и минимизированными побочными эффектами. Мы решили подробней остановиться на этой инновационной стороне фармакологической отрасли и осветить ее в цикле материалов о современных лекарственных формах, которые уже есть в наших аптеках или вот-вот появятся в ассортименте. И начнем мы погружение в интересный мир современных фармтехнологий с понятия, которое уже знакомо провизорам и фармацевтам, — модифицированного высвобождения лекарственных веществ.
Где действующее вещество, Лебовски?
Наверное, самой ранней попыткой создания лекарственной формы (ЛФ) с регулируемым высвобождением стала работа профессора Израэля Лебовски, который в 1938 году предложил использовать пероральные пеллеты, покрытые оболочкой, обеспечивающей пролонгированное высвобождение действующего вещества. Так же как и современные фармакологи, Лебовски хотел создать идеальное лекарство, быстро проникающее в зону действия в оптимальной концентрации и сохраняющееся в необходимой дозе определенный период времени, достаточный для достижения терапевтического эффекта [2]. Безусловно, с 30‑х годов прошлого века технологии ушли далеко вперед, но принцип, задекларированный Лебовски, остался неизменным.
Современные препараты с модифицированным высвобождением характеризуются в первую очередь изменением механизма и характера высвобождения лекарственного вещества. Они могут быть предназначены для разных путей введения — перорального, парентерального, имплантационного, трансдермального, ингаляционного и других.
Пероральные лекарственные формы с модифицированным высвобождением могут обозначаться различными английскими и русскими терминами [1].
Таблица 1: Термины для ЛФ с модифицированным высвобождением
| Аббревиатура (англ.) | Вид лекарственной формы | |
| Английское название | Русское название | |
| ER, XR | Extended release | Длительное высвобождение |
| SR | Sustained (slow) release | Пролонгированное (замедленное) высвобождение |
| CR | Controlled release | Контролируемое высвобождение |
| CD | Controlled delivery | Контролируемая доставка |
| СС | Coat-core system | Система «оболочка-ядро» |
| LA | Long-acting | Длительное действие |
| PF | Prolonged action | Пролонгированное действие |
| SL | Short-long form | Двухфазное высвобождение |
| XL | Extra-long | Экстрадлительное высвобождение |
| ZOK | Zero-order kinetics | Кинетика нулевого порядка |
| OROS | Oral osmotic system | Пероральная осмотическая система |
| L-OROS | Liquid oral osmotic system | Жидкостная пероральная осмотическая система |
| GITS | Gastrointestinal therapeutic system | Желудочно-кишечная терапевтическая система |
Технологии модифицированной доставки
Для модификации высвобождения и доставки лекарственного вещества применяются различные методы [3].
Таблица 2: Методология модификации высвобождения
| Физические методы | Использование вспомогательных веществ, изменяющих растворимость, всасывание, распределение, элиминацию; использование физических сил – диффузии, осмоса, гидродинамики, аэродинамики и так далее |
| Химические методы | Образование солей, комплексов, добавление или замена функциональных химических групп в молекуле лекарственного вещества, конъюгация (биосинтез, – прим. ред.) с веществом-носителем |
| Технологические методы | Производство наноразмерных лекарственных форм – создание матриц, однослойных или многослойных оболочек, резервуаров, микросфер, липосом, наночастиц; микрогранулирование, микрокапсулирование |
| Применение таргетных инновационных препаратов | Обеспечение наноразмерного воздействия на биомишень и достижение оптимального терапевтического эффекта |
При использовании разных технологий модифицированного высвобождения можно получить пероральные лекарственные формы двух типов:
- Формы матриксного (монолитного) типа — представляют собой медленно распадающиеся матриксные монолитные таблетки.
- Формы резервуарного типа, содержащие осмотические насосы или микрокапсулы с собственными распадающимися оболочками.
В монолитных формах модификацию высвобождения обеспечивает медленно распадающееся вещество полимерной природы, которое способно к разрушению или набуханию с образованием пор. В качестве матриц часто используются [2, 3]:
- гидрогели — при их набухании образуются ячейки или поры определенного размера, обеспечивающие замедленное высвобождение лекарственного вещества;
- ионообменные резины — гидрофобные матрицы, плохо растворимые в воде;
- восковые матрицы;
- полимерные матрицы и т. д.
В резервуарных формах модифицированное высвобождение обеспечивают оболочки — прессованные, многослойные, кишечнорастворимые и другие. Их прессование позволяет включать лекарственное вещество как в ядро таблетки, так и в оболочку в качестве второго слоя. Яркий пример резервуарной формы — прессованная таблетка (coat-core). Она содержит две фазы лекарственного вещества, которые растворяются в определенное время: вещество, входящее в состав оболочки, — в первые 12 часов после приема, а содержимое в ядре — в следующие 12 часов после приема таблетки.
Рассмотрим самые распространенные формы модифицированного высвобождения более подробно.
Очень популярной формой модификации высвобождения активного вещества является форма резервуарного типа с кишечнорастворимыми оболочками. Она может обеспечивать решение сразу нескольких задач:
- защита лекарственного вещества от кислой среды желудка;
- защита слизистой оболочки желудка от повреждающего действия лекарственного вещества;
- целенаправленное высвобождение препарата в тонком кишечнике;
- повышение абсорбции действующего вещества в первичном месте всасывания и др.
Для создания кишечнорастворимых оболочек используются pH-чувствительные полимеры, растворимые при pH >5. Благодаря способности растворяться в среде с четко установленным водородным показателем они остаются устойчивыми в кислой среде желудка, но быстро растворяются в тонком кишечнике.
Первые осмотические системы появились на фармацевтическом рынке в начале 80‑х годов прошлого века — они использовались для создания препаратов индометацина. Этот опыт нельзя назвать успешным. Из-за зарегистрированных случаев выраженного раздражения слизистой ЖКТ и перфорации пищеварительного тракта препарат был отозван из обращения. Тем не менее, осмотические насосы получили широкое распространение и стали одним из самых востребованных инновационных способов контроля высвобождения лекарственного вещества.
Внешне осмотические системы выглядят, как обычные таблетки, однако представляют собой резервуар для лекарственных компонентов и осмотического вещества. Он имеет отверстие диаметром 300–500 мкм, сформированное с помощью лазерного луча. Сам резервуар окружает полупроницаемая оболочка. После приема таблетки вода проникает через нее, и лекарственное вещество частично растворяется с образованием суспензии. При этом создается осмотическое давление. Для его повышения иногда в состав препарата вводятся осмотические агенты — хлорид натрия, хлорид калия, ксилит [4]. Осмотическое давление обеспечивает выведение лекарственной суспензии из резервуара через отверстие со скоростью, равной скорости проникновения в систему жидкости.
В некоторых современных осмотических системах используются несколько слоев-оболочек: наружный, имеющий поры, и внутренний, «толкающий». Он состоит из материала, расширяющегося в присутствии воды и за счет этого выталкивающего слой лекарственного вещества из отверстия с контролируемой скоростью.
Все пероральные осмотические системы очень стабильны в желудочно-кишечном тракте, не реагируют на колебания pH, моторику кишечника, прием пищи и другие факторы.
Системы множественных микрогранул, или пеллет
Лекарственные формы этого типа имеют множество микрогранул, размещенных в матриксе и заключенных в таблетку или макрокапсулу (спансулу). Пеллеты (от англ. рellet — «шарик», «гранула», «дробинка») представляют собой частицы лекарственного вещества малого размера — микрогранулы, микросферы, мини-таблетки и так далее. Они могут быть как готовой лекарственной формой, так и промежуточным этапом в производстве готовой формы.
Чаще всего пеллеты производят путем компактирования и нанесения лекарственного вещества на фармакологически инертные микросферы, к которым предъявляется ряд требований [5]:
- гладкая поверхность и форма, приближающаяся к сферической;
- размер 600–1000 мкм;
- строго выверенная дозировка лекарственного вещества.
Пеллетам свойственна высокая текучесть, поэтому их легко компактировать до однородного состояния. Лекарственная форма с множеством пеллет может включать микросферы с разными активными и вспомогательными веществами, что позволяет объединять в одном препарате два и более действующих компонентов. При этом они могут быть как совместимыми, так и несовместимыми, а также всасывающимися в одном или разных отделах ЖКТ [5].
Лекарственная форма с системой множественных пеллет имеет ряд преимуществ: таблетки, созданные по этой технологии, можно делить, в их составе можно комбинировать два и более лекарственных препарата, в том числе и несовместимых. Это позволяет повысить профиль безопасности лекарственного средства и его эффективность.
Типы модифицированного высвобождения
Лекарственные формы с модифицированным высвобождением различаются по ряду критериев:
- По степени управления процессом высвобождения — контролируемое, пролонгированное (или замедленное) высвобождение.
- По кинетике высвобождения — непрерывное, прерывистое, отсроченное, пульсирующее.
- По модификации терапевтического эффекта — времени наступления эффекта, его продолжительности, выраженности.
Для препаратов с контролируемым высвобождением свойственно изменение времени высвобождения активного ингредиента в соответствии с характеристиками терапевтического эффекта. Препараты с этой формой выпуска должны отвечать следующим требованиям:
- процесс высвобождения действующего вещества должен описываться известным видом математической зависимости;
- высвобождение активного ингредиента должно проходить по заданной программе с заранее известной скоростью;
- высвобождение не должно зависеть от действия различных физиологических и патологических факторов — приема пищи, действия пищеварительных ферментов и так далее.
При соблюдении всех этих условий процесс высвобождения становится предсказуемым, точным по скорости, продолжительности и месту высвобождения, что позволяет прогнозировать терапевтический эффект. Если какое‑то из этих условий не выполняется, лекарственная форма является пролонгированной.
Из лекарственных форм с пульсирующим или прерывистым высвобождением лекарственное вещество высвобождается в определенное время или через определенный период времени в необходимом месте и требуемой дозировке. Как правило, такие формы имеют резервуарный тип устройства, а механизм высвобождения обеспечивают оболочки, осмотические системы и другие технологические приемы. Период высвобождения регулируется толщиной, пористостью оболочки или свойствами полимерной «пробки».
В системы с модифицированным пульсирующим высвобождением под полупроницаемую наружную оболочку вводят слой полимера, обеспечивающего период плато с заданной продолжительностью (примерно 4–5 часов), и отсроченное время действия препарата. Чтобы обеспечить повторное высвобождение, применяют многослойные системы или системы со множественными пеллетами.
Модифицированные формы: день сегодняшний
Создание лекарственных форм с модифицированным высвобождением позволяет контролировать процесс доставки активных компонентов, управлять терапевтическим эффектом, улучшить переносимость лекарственных препаратов, повысить приверженность к терапии и достичь оптимального по выраженности и продолжительности эффекта. На сегодняшний день фармкомпаниям удалось создать формы с модифицированным высвобождением для ряда препаратов, применяющихся для лечения сердечно-сосудистых заболеваний, сахарного диабета, а также антибиотиков, ферментов и гормональных лекарственных средств.
Таблица 3: Примеры препаратов, имеющих ЛФ с модифицированным высвобождением
| Лекарственная форма | Препараты (МНН) |
| Форма с замедленным высвобождением |
|
| Форма с двухфазным высвобождением (short-long) |
|
| Форма с контролируемым высвобождением (coat-core) |
|
| Форма с контролируемым высвобождением (система с множественными пеллетами) |
|
| Формы с контролируемым отсроченным высвобождением |
|
| Пероральные осмотические системы |
|
Широкие возможности, которые открывают для фармакотерапии лекарственные формы с модифицированным высвобождением, стали мощным катализатором дальнейшего развития инновационных технологий и появления ультрасовременных нано- и таргетных препаратов. Но об этом — в следующей статье.
- Сысуев Б. Б., Плетнева И. В. Современное состояние исследований разработок в области инновационных лекарственных форм и их модификаций // Вестник Волгоградского государственного медицинского университета, 2014. № 4. С. 52.
- Robinson J. R., Gauger L. J. Formulation of controlled-release products //Journal of Allergy and Clinical Immunology. 1986; 78 (4): 676–681.
- Леонова М. В. Новые лекарственные формы и системы доставки лекарственных средств: особенности пероральных лекарственных форм. Часть 2 // Лечебное дело, 2009. № 3. С. 18–26.
- Malaterre V. et al. Oral osmotically driven systems: 30 years of development and clinical use //European Journal of Pharmaceutics and Biopharmaceutics. 2009; 73 (3): 311–323.
- Ахметалимова А. М. и др. Пеллеты как лекарственная форма для антиоксидантного средства оксима пиностробина // Мир науки и молодежь: традиции и инновации, 2014. С. 39–41.
- Prajapati S. T., Patel A. N., Patel C. N. Formulation and evaluation of controlled-release tablet of zolpidem tartrate by melt granulation technique //International Scholarly Research Notices. 2011.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Источник



