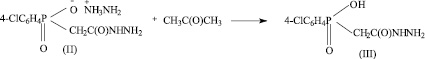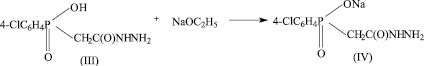Определение доброкачественности лрс
Доброкачественность ЛРС — соответствие ЛPC, продуктов и лекарственных средств из него требованиям стандарта (числовым показателям качества и безопасности для применения).
показатели качества сырья;
показатели безопасности сырья.
К показателям качества относятся содержание допустимых примесей (органических и минеральных), измельченность, влажность, зольность, количество действующих веществ.
К показателям безопасности ЛРС относятся уровень содержания радионуклидов (цезия-137 и стронция-90), микробиологическая чистота, содержание токсичных элементов, пестицидов и токсичных веществ (микотоксины).
Доброкачественность ЛРС определяется с помощью товароведческого, химического и биологического анализов.
Товароведческий анализ ЛРС включает определение:
содержания допустимых примесей;
степени заряженности сырья амбарными вредителями.
Химический анализ включает определение:
содержания экстрактивных и действующих веществ;
влажности (потери в массе сырья при высушивании при 100-105ºС);
зольности (общей и нерастворимой в 10% HCl);
содержания токсичных элементов (Pb, As, Cd, Hg);
пестицидов и токсичных веществ (микотоксины).
Биологический анализ включает определение:
биологической активности ЛРС;
микробиологической чистоты ЛРС;
биологическую стандартизацию ЛРС.
Макроскопический, микроскопический и качественный химический методы при анализе качества сырья используются не так широко, поскольку они не дают полноценной информации.
Роль макроскопического метода в анализе доброкачественности заключается в том, что при внешнем осмотре сырья возможно обнаружение недопустимых примесей, а так же может быть установлено количество допустимых примесей, явно превышающих разрешенные пределы по НД.
Роль микроскопического метода сводится к подтверждению посторонних примесей, в случае затруднения использования макроскопического анализа.
Роль качественного химического метода состоит не только в обнаружении БАВ, присущих данному виду сырья, но и в выявлении различных примесей.
Доброкачественность ЛРС определяется при приемке ЛРС и включает:
1) Приемку лрс; 2) отбор проб; 3) проведение испытаний.
Приёмка лекарственного растительного сырья и методы отбора проб для анализа на складах, базах и фармацевтических перерабатывающих предприятиях
Правила приёмки лекарственного растительного сырья и методы отбора проб регулируются ОФС 2.8.20 ГФ РБ II.
Приёмка лекарственного растительного сырья проводится партиями («ангро») или сериями (фасованное сырьё).
Партия — определённое количество цельного, обмолоченного, прессованного лекарственного растительного сырья одного наименования, однородное по способу подготовки и показателям качества, оформленное одним документом, удостоверяющим его качество, предназначенное для производства промышленных серий фасованной продукции в упаковке «ангро» и в потребительской упаковке.
номер и дату выдачи документа, адрес отправителя;
массу партии (серии);
год, месяц заготовки (для «ангро»);
район заготовки (для дикорастущих лекарственных растений);
результаты испытаний качества сырья (таблица);
вид НД на лекарственное растительное сырьё;
подпись лица, ответственного за качество, с указанием фамилии и должности.
Серия лекарственного растительного сырья — определённое количество однородного по всем показателям фасованного лекарственного растительного сырья (цельное, измельчённое, порошок) одного наименования, произведенное в течение одного технологического цикла или в течение определенного интервала времени, в одних и тех же условиях, одновременно представленное на контроль и оформленное одним документом качества. Серия формируется из одной или нескольких (не более 3) партий сырья.
Партия (серия) состоит из единиц продукции (транспортная упаковка: мешки, ящики, тюки и др.).
Транспортная упаковка лекарственного растительного сырья (единицы продукции) — упаковка, представляющая один из видов транспортной тары, указанная в частных фармакопейных статьях.
Потребительская упаковка с лекарственным растительным сырьём — упаковка лекарственного средства, поступающая к потребителю, обеспечивающая его сохранность и неизменность свойств в течение установленного срока годности.
Фасованная продукция — определённое количество (масса) лекарственного растительного сырья цельного, измельчённого или порошка, помещённое в потребительскую упаковку, предназначенное для приготовления настоев и отваров, или в упаковку «ангро», предназначенную для изготовления лекарственных средств (настоек, экстрактов и др.).
Приёмка лекарственного растительного сырья включает:
внешний осмотр упаковки;
определение её качества, цельности;
определение правильности маркировки и оформления сопроводительной документации;
проверку соответствия тары и упаковки требованиям НД на конкретное сырье;
Пробы отбираются только из неповреждённых единиц продукции, упакованных согласно стандартам качества (ФСП). Проверку качества лекарственного растительного сырья в повреждённых единицах продукции производят отдельно от неповреждённых, вскрывая каждую единицу продукции.
Не допускается отбор проб одновременно от двух партий или серий. Виды продукции, подлежащие отбору проб:
лекарственное растительное сырьё «ангро» (партия);
фасованное лекарственное растительное сырьё (серия).
Отбор образцов для испытаний осуществляет представитель анализирующей организации или подразделения. Должны соблюдаться санитарно-гигиенические требования; при отборе проб ядовитого и сильнодействующего лекарственного растительного сырья соблюдают меры предосторожности, предусмотренные соответствующими инструкциями и положениями.
Пробы отбираются в количестве, необходимом для проведения трёх анализов (включая арбитражный).
Серия (партия) лекарственного растительного сырья, от которой отобраны образцы на анализ, должна храниться изолированно до получения результатов контроля.
Арбитражные образцы хранятся в течение срока годности лекарственного растительного сырья в специальных помещениях, обеспечивающих их сохранность в условиях, предусмотренных НД. По истечении срока хранения образцы, не удовлетворяющие требованиям стандартов качества, подлежат уничтожению в установленном порядке.
Для уменьшения влияния способа отбора на качественный и количественный анализ необходимо, чтобы состав испытуемого образца репрезентативно характеризовал всю испытуемую серию (партию). Для отбора проб лекарственного растительного сырья могут быть использованы приведенные ниже процедуры.
Каждую единицу продукции подвергают внешнему осмотру для установления соответствия упаковки и маркировки требованиям нормативной документации. Обращают внимание на правильность упаковки, состояние тары (отсутствие подмочки, подтеков и других повреждений, отрицательно влияющих на качество и сохранность сырья).
Для проверки соответствия качества сырья требованиям нормативной документации отбирают выборку из неповрежденных единиц продукции, взятых случайным образом из разных мест серии (партии) в количестве, указанном в таблице 2.8.20.-1. Проверку качества сырья в поврежденных единицах продукции производят отдельно от неповрежденных, вскрывая каждую единицу продукции.
Количество контейнеров в партии лекарственного растительного сырья
Количество отбираемых контейнеров
10 % контейнеров от серии (партии)*
*Неполные 10 единиц продукции приравниваются к 10 единицам (например, при наличии в партии 51 единицы продукции объём выборки составляет 6 единиц).
Попавшие в выборку единицы продукции вскрывают и путем внешнего осмотра определяют:
однородность сырья по способу подготовки (цельное, измельченное, прессованное и т. д.), цвету, запаху, засоренности;
наличие примесей (плесени, гнили, устойчивого постороннего запаха, не исчезающего при проветривании;
засоренность ядовитыми растениями и такими примесями, как камни, стекло, помет грызунов и птиц и т. п.).
Одновременно невооруженным глазом и с помощью лупы (5—10*) определяют наличие амбарных вредителей.
При установлении при внешнем осмотре неоднородности ЛРС, наличия плесени и гнили, засоренности посторонними растениями в количествах, явно превышающих допустимые примеси, партия может быть принята только после того, как будет рассортирована и вторично предъявлена к сдаче.
При обнаружении признаков гниения, плесени, устойчивого постороннего запаха, не исчезающего при проветривании; засоренности ядовитыми растениями и такими примесями, как стекло, помет грызунов и птиц и т. п. партия сырья не подлежит приемке.
Из каждой единицы продукции, отобранной для вскрытия, берут, избегая измельчения, 3 точечные пробы: сверху, снизу и из середины. Из мешков, тюков и кип точечные пробы отбирают на глубине не менее 10 см сверху, затем, после распарывания по шву, из середины и снизу; точечные пробы семян и сухих плодов отбирают зерновым щупом. Из сырья, упакованного в ящик, первую точечную пробу отбирают из верхнего слоя, вторую — после удаления сырья примерно до половины ящика, и третью — со дна ящика. Точечные пробы должны быть примерно одинаковыми по массе.
Отобранные точечные пробы выкладывают на гладкую, чистую ровную поверхность (не смешивая) и после завершения отбора всех точечных проб еще раз просматривают на наличие допустимых и недопустимых примесей.
Затем из всех точечных проб, осторожно перемешивая, составляют объединенную пробу, которую взвешивают. Масса пробы, отбираемой из каждого контейнера, должна быть такой, чтобы масса объединенной пробы была достаточна для проведения всех испытаний; в противном случае отбор точечных проб повторяют. Требуемую массу объединенной пробы определяют суммируя массы аналитических проб.
Из объединенной пробы методом квартования (см. примечание ниже) выделяют:
при обнаружении присутствия амбарных вредителей и при необходимости определения степени зараженности амбарными вредителями отбирают аналитическую пробу массой 500 г для мелких видов сырья и массой 1000 г для крупных видов сырья;
аналитическую пробу для определения микробиологической чистоты (50 г);
аналитическую пробу для определения радионуклидов (размер пробы определяют в зависимости от используемого метода определения радионуклидов) – 500 – 1000 г;
среднюю пробу (250 или 500 г) — в соответствии с таблицей для проведения остальных видов анализа.
Тип лекарственного растительного сырья
Минимальный вес средней пробы
Корни, корневища, кора, травы (цельное и измельченное сырье)
Листья, цветки, семена, плоды (цельное и измельченное сырье)
ПРИМЕЧАНИЕ: при квартовании лекарственное растительное сырье разравнивают на гладкой, чистой, ровной поверхности в виде квадрата по возможности тонким равномерным по толщине слоем и по диагонали делят на четыре треугольника. Два противоположных треугольника удаляют, а два оставшихся соединяют вместе и перемешивают. Эту процедуру повторяют до тех пор, пока не останется количество сырья в двух противоположных треугольниках, соответствующее массе заданных проб. Допустимые отклонения в массе каждой из проб не должны превышать ±10%.
Пробу для установления степени заражённости амбарными вредителями помещают в плотно закрывающуюся ёмкость. Среднюю пробу и пробы для определения радионуклидов и микробиологической чистоты упаковывают каждую в полиэтиленовый или многослойный бумажный пакет. К пакету или ёмкости прикрепляют этикетку, такую же этикетку вкладывают внутрь мешка или ёмкости.
Оставшуюся после макроскопического анализа (2.8.23), определения степени измельчения (2.9.12) и содержания примесей (2.8.2) часть средней пробы измельчают ножницами или секатором до размеров частиц около 1 см, если в частной статье нет других указаний, перемешивают и выделяют методом квартования аналитические пробы для определения влажности, золы и действующих веществ, пестицидов, токсических элементов и микотоксинов.
ОТБОР ПРОБ ФАСОВАННОЙ ПРОДУКЦИИ
Лекарственное растительное сырье сборы расфасовываются в пачки, пакеты, фильтр-пакеты (в цельном, резаном, дробленом, порошкованном виде), а также выпускаются в форме брикетов (в резано-прессованном виде).
Единицы продукции в выборку необходимо отбирать из разных мест контролируемой серии (партии).
Объем выборки зависит от размера серии (партии). Количество упаковочных единиц, отобранных для отбора, рассчитывается по формуле:

где n – общее количество упаковочных единиц одной серии (партии).
В случае недостаточного количества потребительских упаковок для проведения испытания, их повторно отбирают, как указано выше.
Отобранные потребительские упаковки составляют объединенную пробу.
Из объединенной пробы выделяются пробы:
средняя проба в соответствии с таблицей 2.8.20.-2 (но не менее 10 невскрытых пачек или пакетов;
проба для определения допустимых отклонений на промышленное фасование (10 невскрытых контурных ячейковых упаковок, брикетов; 20 невскрытых фильтр-пакетов);
проба для определения микробиологической чистоты — 3 невскрытых потребительских упаковок общей массой не менее 50 г;
проба для определения радионуклидов — в соответствии с используемым методом определения радионуклидов.
Источник
Что такое доброкачественность лекарственного средства
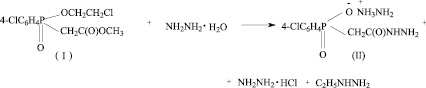
Поиск новых лекарственных препаратов с нейротропной активностью привел к открытию нового ряда биологически активных веществ (БАВ) – гидразидов фосфорилированных уксусных кислот. Ранее сотрудниками кафедры фармакологии ГБОУ ВПО «КГМУ МЗ РФ» было установлено, что данные БАВ проявляют выраженные психотропные свойства, обладают антигипоксической активностью, улучшают процессы восприятия и запоминания, обладают низкой токсичностью и не проявляют антихолинэстеразной активности [7, 8].
Одним из наиболее активных представителей этого ряда является натриевая соль ацетилгидразино-4-хлорфенилфосфиновой кислоты (Na-CPAH), синтезированная на кафедре органической химии ГБОУ ВПО КНИТУ. В предыдущих работах мы установили, что исследуемое БАВ обладает выраженной антидепрессивной активностью и способностью положительно влиять на процессы обучения и памяти [6], а также разработали оптимальные методики качественного и количественного анализа Na-CPAH [5].
Важной задачей фармацевтического анализа является определение содержания посторонних примесей в лекарственных препаратах. В этой связи представляло интерес провести экспериментальную работу по выбору условий определения посторонних примесей в Na-CPAH. [1].
Целью настоящей работы является разработка методик определения доброкачественности субстанции Na-CPAH, необходимых для оценки качества данного лекарственного вещества с целью ее стандартизации.
Объектом исследования является субстанция БАВ Na-CPAH, физико-химичекие свойства которого нами были ранее изучены [5]. В качестве обязательных параметров доброкачественности ГФ регламентирует включать в ФС следующие разделы: «прозрачность раствора», «цветность раствора», «рН», «посторонние примеси», «потеря в массе при высушивании», «хлориды», «сульфаты», «сульфатная зола и тяжелые металлы», «мышьяк» и т.д. [2, 3].
Параметр «прозрачность раствора» определяли путем визуального сравнения одинакового объема испытуемой жидкости с эталоном I при освещении электрической лампы матового стекла мощностью 40 Вт, расположенной над образцом, просматривая растворы перпендикулярно вертикальной оси пробирок на черном фоне через 5 мин после приготовления эталона. Опалесценция анализируемого раствора не должна превышать опалесценцию эталона.
Прозрачность раствора. 0,1 г субстанции растворяют в 10 мл свежепрокипяченной и охлажденной воды. Полученный раствор должен быть прозрачным или выдерживать сравнение с эталоном I.
Цветность раствора определяли по стандартам для бесцветных жидкостей – раствор анализируемого вещества должен выдерживать сравнение с эталоном В9. Сравнивали окраску в отраженном свете на матово-белом фоне.
Цветность раствора. Окраска раствора, полученного в испытании на прозрачность раствора, должна быть бесцветной или выдерживать сравнение с эталоном B9.
Посторонние примеси. Хроматографические методы анализа примесей в препаратах являются наиболее чувствительными и избирательными, позволяющими определить чистоту лекарственного вещества.
Синтез натриевой соли ацетилгидразино-4-хлорфенилфосфиновой кислоты состоит из трех стадий [6].
Одной из возможных примесей является промежуточный продукт синтеза ацетилгидразино-4-хлорфенилфосфиновая кислота (III) (HO-CPAH). Нами предложена методика определения чистоты БАВ Na-CPAH методом ТСХ. Были проведены экспериментальные исследования по параметрам методики, приведенным ниже.
Для хроматографирования выбраны пластины Sorbfil (10×15 см), марка ПТСХ-АФ-А-УФ, аналитические (ТУ 26-11-17-89), на алюминиевой подложке.
В качестве стандартного образца вещества свидетеля (СОВС) использовалась ацетилгидразино-4-хлорфенилфосфиновая кислота (чистота 100 %), полученная в лаборатории органического синтеза КНИТУ. Данное соединение было охарактеризовано с помощью спектральных методов анализа в инфракрасной и ультрафиолетовой областях.
Чувствительностью обнаружения примеси 0,25 мкг.
Определен способ детектирования – в ультрафиолетовом свете при 254 нм.
Предварительно изучена хроматографическая подвижность Na-CPAH и его возможных примесей в нижеприведенных системах растворителей, рекомендованных для фосфорорганических соединений [4]:
1. Хлороформ:ацетон:этанол (6:6:1).
2. Хлороформ:ацетон (1:1).
3. Хлороформ:этанол:аммиак (15:35:1).
4. Хлороформ:ацетон:этанол:вода (24:4:4:1).
5. Ацетон:этанол:аммиак (10:10:0,5).
6. Хлороформ:ацетон:этанол (9:3:1).
7. Бензол:этанол (9:1).
8. Этанол:бензол:аммиак (30:20:1).
9. Этанол:хлороформ:NaOH (80:20:5).
Изучена возможность использования в качестве подвижной фазы воды, ацетона, хлороформа, спирта этилового, эфира, раствора аммиака, а также смесей указанных растворителей.
Для наиболее эффективного анализа веществ нами было проведено изучение оптимального количества наносимого вещества и его примеси. С этой целью наносили на линию старта хроматографических пластинок вещества в количестве 5, 10, 50, 100 и 200 мкг/мл.
На линию старта хроматографической пластинки «Sorbfil» наносили 100 мкг/мл водного раствора исследуемого БАВ и 0,5 мкг/мл его возможной примеси (HO-CPAH), хроматографирование осуществляли восходящим способом.
На основании результатов проведенных исследований для определения примесей в субстанции Na-CPAH выбрана система растворителей – этанол:хлороформ:аммиака раствор концентрированный 25 % (80:20:5), в которой пятна изучаемой субстанции БАВ и примеси HO-CPAH (Rf 0,58 и 0,42 соответственно) компактны, имеют четкие границы и достаточную степень разделения.
Проверка пригодности хроматографической системы проводится по хроматограмме образца субстанции, содержащего известное количество примеси: пятна должны быть четко видны на хроматограмме и разделяться между собой (рис. 1).
Ацетилгидразино-4-хлорфенилфосфиновая кислота – посторонняя примесь БАВ Na-CPAH ‒ была обнаружена лишь в одной из пяти серий субстанции (рис. 2).
Посторонние примеси. Определение проводят методом ТСХ.
Испытуемый раствор: 0,1 г субстанции растворяют в 10 мл воды очищенной.
На линию старта пластинки «Sorbfil» (10×15 см) наносят 10 мкл (100 мкг) испытуемого раствора и раствор СОВС, содержащий 0,5 мкг примеси. Пластинку с нанесенными пробами сушат на воздухе, помещают в камеру со смесью этанол:хлороформ:аммиака раствор концентрированный 25 % (80:20:5) и хроматографируют восходящим методом. Когда фронт подвижной фазы дойдет до конца пластинки, ее вынимают из камеры, сушат на воздухе и просматривают в УФ-свете при 254 нм. Пятно посторонней примеси на хроматограмме испытуемого раствора по совокупности величины и интенсивности поглощения не должно превышать пятно на хроматограмме раствора сравнения (не более 0,5 %).
Рис. 1. Хроматограмма проверки пригодности хроматографической системы. Условные обозначения: 



Потерю в массе при высушивании для изучаемой субстанции предлагается определять при температуре 100–105 °С. Субстанцию высушивали до постоянной массы.
Потеря в массе при высушивании. Около 0,5 г (точная навеска) субстанции сушат при температуре от 100 до 105 °С до постоянной массы. Потеря в массе не должна превышать 0,5 %.
Рис. 2. Хроматограмма определения посторонних примесей в субстанции Na-CPAH
Содержание хлоридов в анализируемом БАВ определяли согласно требованиям ГФ. Опалесценция, появившаяся в испытуемом растворе, не должна превышать эталон. Предельная чувствительность реакции – 0,0001 мг (0,1 мкг) хлорид-иона в 1 мл раствора.
Хлориды. 0,5 г субстанции растворяют в 25 мл воды. 10 мл полученного раствора должны выдерживать испытание на хлориды (не более 0,01 % в субстанции).
Содержание сульфатов в изучаемом БАВ основывалось на способности сульфат-ионов образовывать с растворами солей бария белый осадок. Испытуемый раствор должен выдерживать испытание в сравнении с эталоном.
Сульфаты. 10 мл раствора, полученного в испытании на хлориды, должны выдерживать испытание на сульфаты (не более 0,05 % в субстанции).
Для определения сульфатной золы точную навеску субстанции помещали в предварительно взвешенный фарфоровый тигель, смачивали в 1 мл серной кислоты концентрированной и прокаливали при температуре около 600 °С до постоянной массы в муфельной печи. По окончании прокаливания тигель охлаждали в эксикаторе и взвешивали.
Сульфатная зола и тяжёлые металлы. Сульфатная зола из 1 г субстанции (точная навеска) не должна превышать 0,1 % и должна выдерживать испытание на тяжёлые металлы (не более 0,0005 % в субстанции).
Мышьяк. 0,5 г субстанции не должны давать реакции на мышьяк.
1. Разработанные методики определения прозрачности, цветности раствора, рН, потери в массе при высушивании, примесей хлоридов, сульфатов, мышьяка, сульфатной золы и тяжелых металлов позволяют надежно контролировать доброкачественность БАВ Na-CPAH.
2. Подобранные оптимальные условия хроматографирования БАВ Na-CPAH способствуют высокочувствительному определению посторонних примесей в субстанции.
Рецензенты:
Егорова С.Н., д.фарм.н., профессор, заведующая кафедрой ФПК и ППС, ГБОУ ВПО «КазГМУ», г. Казань;
Шакирова Д.Х., д.фарм.н., профессор кафедры управления и экономики фармации, ГБОУ ВПО «КазГМУ», г. Казань.
Источник