Демиелинизирующие заболевания
Опубликовано пт, 29/06/2018 — 07:57
Демиелинизирующие расстройства — заболевания, основным патологическим процессом при которых является демиелинизация — разрушение, потеря миелиновой оболочки нейронов центральной или периферической нервной системы. Повреждение миелиновой оболочки ухудшает проводимость сигналов в пораженных нервах.
Демиелинизирующие заболевания по своему патогенезу чаще всего носят характер аутоиммунных процессов , реже, как проявление генетических заболеваний ( гипотезы о роли генетики и аутоиммунных дефицитах в этиологии демиелинизирующих заболеваний не могут объяснить многие случаи этих расстройств) . Кроме того , эти расстройства могут быть вызваны нейролептиками.
Некоторые демиелинизирующие заболевания могут быть вызваны инфекционными агентами , а некоторые — неизвестными факторами. Органофосфаты — класс химических веществ, которые являются активными ингредиентами инсектицидов, таких, как некоторые » сорняки — убийцы» , препараты для лечения блоху домашних животных и т.д., также демиелинизируют нервы. Дефицит витамина В12 также может привести к демиелинизации.
В отличие от других приматов, люди демонстрируют уникальную картину постпубертатной миелинизации, которая может способствовать развитию психических расстройств и нейродегенеративных заболеваний, возникающих в раннем взрослом возрасте и за его пределами. Продолжительный период кортикального миелинирования у людей предоставляет большую возможность для нарушения процесса миелинизации, в результате чего повышается риск возникновения демиелинизирующего заболевания. Кроме того, было отмечено, что люди имеют значительно больший префронтальный объем белого вещества, чем другие виды приматов, что подразумевает и большую плотность миелина. Таким образом, повышенная плотность миелина у людей в результате длительного процесса миелинирования может повысить риск дегенерации и дисфункции миелина.
Демиелинизацию можно разделить на 2 типа:
- миелинопатия — разрушение уже сформированного миелина из-за причин, связанных с биохимическим дефектом строения миелина, как правило, генетически обусловленным (например, болезнь Канавана, лейкодистрофические заболевания);
- миелинокластия — разрушение нормально синтезированного миелина под влиянием различных воздействий ( интоксикация, аутоиммунный процесс , химические вещества и др.) , как внешних, так и внутренних (например, болезнь Бинсвангера)
Подразделение демиелинизирующих заболеваний на эти две группы условно, так как первые клинические проявления миелинопатий могут быть связаны с воздействием различных внешних факторов, а миелинокластии вероятнее всего развиваются у предрасположенных к ним лиц. Демиелинизирующие заболевания можно также разделить на те, которые затрагивают центральную нервную систему, и те, которые повреждают периферическую нервную систему.
Демиелинизирующие заболевания центральной нервной системы : рассеянный склероз, болезнь Девика, концентрический склероз Бало , воспалительные демиелинизирующие заболевания ( синдром осмотической демиелинизации; миелопатии, например, спинная сухотка, лейкоэнцефалопатии ( ПМЛ) , лейкодистрофии и др.) . Лейкодистрофии , как правило, связаны также с проявлениями оптического неврита и поперечного миелита , которые являются воспалительными состояниями, поскольку воспаление и демиелинизация часто связаны между собой.
В наиболее известном примере, заболевании под названием рассеянный склероз ( воспалительное демиелинизирующее заболевание центральной нервной системы, которое развивается у генетически восприимчивых лиц после воздействия неизвестного экологического триггера (ов), есть веские доказательства того, что собственная иммунная система организма по меньшей мере частично вовлечена здесь в патологический процесс. Известно, что приобретенные клетки иммунной системы ( Т — клетки) , обнаруживаются в месте поражения ; а другие клетки иммунной системы ( макрофаги и , возможно, тучные клетки) также способствуют повреждению миелина. В то же время , рассеянный склероз, не может быть объяснен только аутоиммунным дефицитом, но это заболевание в значительной степени подразумевает влияние ошибочных процессов развития в патогенезе болезни. По большому счету причины рассеянного склроза (MS) неизвестны, но с большой вероятностью связаны с иммунными реакциями против аутоантигенов, в частности миелиновых белков. Наиболее приемлемой гипотезой является та, согласно которой «диалог» ( взаимодействие ) между рецепторами Т-клеток и миелиновыми антигенами приводит к иммунной атаке на комплекс миелин-олигодендроциты. Эти взаимодействия между активными Т-клетками и миелиновыми антигенами вызывают массивный деструктивный воспалительный ответ и способствуют продолжению пролиферации Т и В-клеток , а также активации макрофагов, которые поддерживают секрецию воспалительных медиаторов.
Демиелинизирующие заболевания периферической нервной системы: синдром Гийена — Барре и его хронический аналог хроническая воспалительная демиелинизирующая полинейропатия;, невральная амиотрофия Шарко — Мари — Тута, анти — MAG периферическая нейропатия , болезни связанные с дефицитом меди ( периферическая нейропатия , миелопатия, редко — зрительная нейропатия) , прогрессивная воспалительная нейропатия и др.
Общие клинические признаки демиелинизации как патологического процесса выделить нельзя. Симптомы зависят от очага локализации демиелинизации в центральной или периферической нервной системы. Ниже приведен список наиболее часто встречающихся симптомов демиелинизирующих заболеваний: диплопия ( «двоение в глазах» ) , атаксия, подергивание мышц, диартрия, чувство усталости, односторонний парез , паралич рук , неуклюжесть движений ; окулярный паралич ( паралич черепно — мозговых нервов), нарушение координации мышц, мышечная слабость, потеря ощущений, парестезии, генитальная анестезия, нарушение зрения , очаговые неврологические симптомы, неуверенная походка, спастический парапарез , недержание мочи , проблемы со слухом и речью.
Основным методом диагностики демиелинизирующего заболевания центральной нервной системы считается магнитно — резонансная томография, которая позволяет выявить очаги диаметром не менее 3 мм («пятна» могут возникать в результате изменения содержания воды в мозге). Кроме того, для диагностики демиелинизирующих заболеваний проводятся исследования вызванных потенциалов. Анализ цереброспинальной жидкости (CSF) может быть полезным при диагностике инфекций центральной нервной системы, а ее культивирование может помочь в выявлении того микроорганизма , который вызвал инфекцию. Восстановление с ослаблением флюидов (FLAIR) использует импульсную последовательность для подавления цереброспинальной жидкости и более отчетливо выявляет поражение и используется, например, при диагностике рассеянного склероза.
Диагностика демиелинизирующего заболевания периферической нервной системы основывается на результатах электронейромиографии.
Лечение обычно связано с улучшением качества жизни пациента. Это достигается посредством «управления симптомами» или замедления темпа демиелинизации. До сих пор нет терапии, которая специально нацелена на врожденные иммунные клетки при рассеянном склерозе. Ожидаемая продолжительность жизни у пациентов с рассеянным склерозом на 5-10 лет ниже, чем у обычных людей. В настоящее время считается, что N-кадгерин играет роль в процессе миелинизации. Эксперименты показали, что N-кадгерин играет важную роль в создании среды, облегчающей ремиелинизацию. На животных моделях было показано, что существует прямая корреляция между количеством присутствующих миелиновых частиц и наблюдаемой степенью воспаления. Эксперименты также показали, что , что манипулирование уровнями гормонов щитовидной железы можно рассматривать как стратегию для содействия процессам ремиелинизации и предотвращения необратимого повреждения у пациентов с множественным ( рассеянным ) склерозом. Агонисты N-кадгерина идентифицированы и используются для стимуляции роста нейритов и миграции клеток, ключевых аспектов развития роста аксонов и ремиелинизации после травмы или заболевания. Было показано, что интраназальное введение aTf ( apotransferrin ) может защитить миелин и вызвать ремиелинизацию. Большая часть исследований была проведена в 2012 году и представляет собой сравнительно новую информацию о демиелинизирующих заболеваниях и потенциальных методах их лечения.
Источник
Рассеянный склероз: можно ли восстановить миелин?
В норме клетки иммунной системы, как и другие клетки крови, не способны проникать непосредственно в нервную ткань – их не пускает так называемый гематоэнцефалический барьер. Но при рассеянном склерозе этот барьер становится проходимым: «сошедшие с ума» лимфоциты получают доступ к нейронам и их аксонам, где и начинают атаковать молекулы миелина, представляющего собой сложную многослойную белково-липидную структуру. Так запускается каскад молекулярных событий, приводящих к разрушению миелина, а иногда и самих аксонов.
Разрушение миелина сопровождается развитием воспаления и склерозированием пораженного участка, т.е. образованием соединительнотканного рубца в виде бляшки, замещающего миелиновую оболочку. Соответственно, в этом участке проводящая функция аксона нарушается. Бляшки расположены диффузно, рассеянно по нервной системе. Именно с таким расположением очагов поражения связано и само название болезни – «рассеянный» склероз, которая не имеет никакого отношения к обычной рассеянности (той, о которой мы иногда говорим в быту – «совсем склероз у меня, опять все забыл»).
Симптомы рассеянного склероза разнообразны, и зависят они от того, какие именно нервы поражены. Среди них – параличи, проблемы с равновесием, когнитивные нарушения, изменения в работе органов чувств (у четверти пациентов развитие заболевания начинается с нарушения зрения из-за неврита зрительного нерва).
Современное лечение рассеянного склероза оставляет желать лучшего.
Эффективного лечения пока не существует, тем более что причины, вызывающие это заболевание, до сих пор не известны, имеются лишь данные о возможном влиянии среды и генетической предрасположенности. Для лечения помимо симптоматической терапии, позволяющей снять боль и уменьшить спазмы мышц, используются препараты глюкокортикоидов для снижения воспаления, а также иммуномодуляторы и иммунодепрессанты, направленные на подавление «плохой» активности иммунной системы. Все эти средства способны замедлить развитие заболевания и снизить частоту обострений, но не излечивают пациента полностью. Не существует и лекарств, способных восстанавливать уже поврежденный миелин.
Однако такое лекарство, направленное именно на восстановление миелина, а не только на замедление патологического процесса, вскоре может появиться. Разработка под рабочим названием Anti-LINGO-1 от швейцарской компании «Biogen», крупнейшего производителя препаратов для терапии рассеянного склероза, сейчас проходит 2 фазу клинических испытаний. Препарат представляет собой моноклональное антитело, способное специфично связываться с белком LINGO-1, который препятствует процессу миелинизации и формированию новых аксонов. Соответственно, если этот белок «выключить», миелин начинает восстанавливаться.
В опытах на животных использование нового препарата приводило к 90-процентной ремиелинизации. У пациентов с рассеянным склерозом, принимающих Anti-LINGO-1, на текущий момент отмечается улучшение проводимости зрительного нерва. Однако полные результаты клинических испытаний на больных будут получены только к 2016 г.
Источник
МИЕЛИНовая защита нейрона: все начинается до рождения
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации
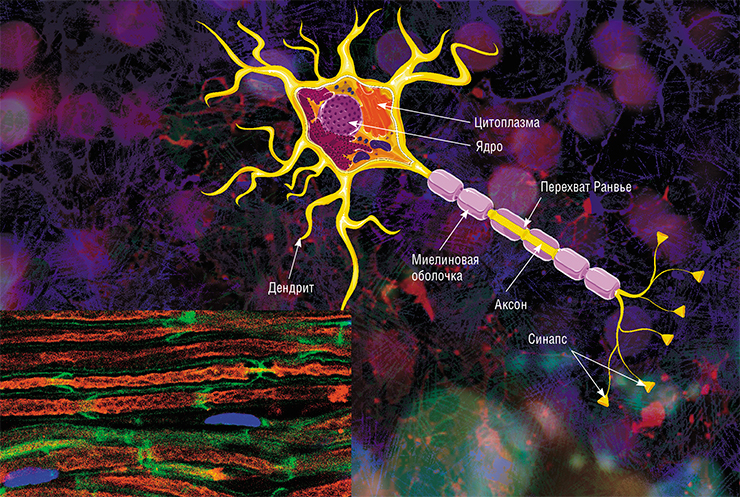
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
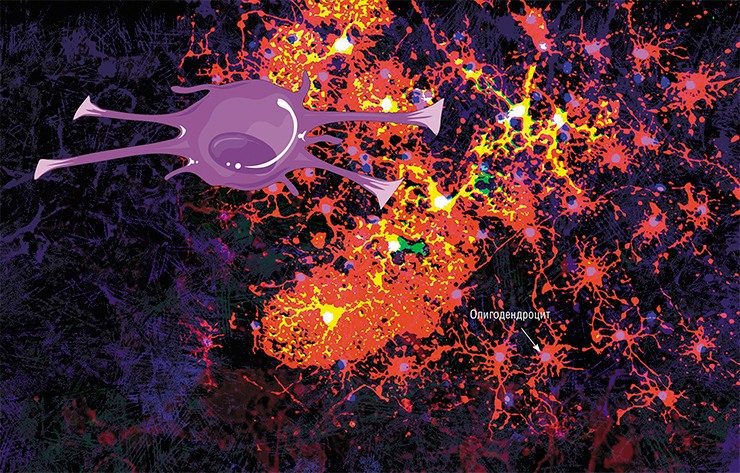
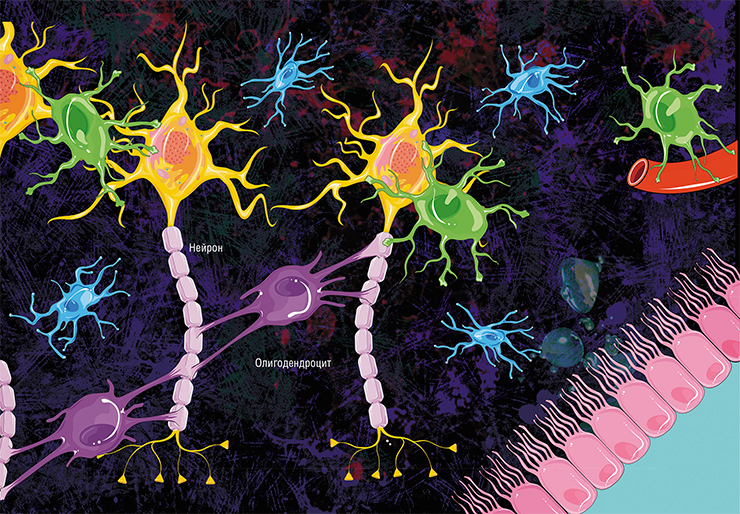
Каждый аксон, подобно проводу, покрыт изоляционным материалом – миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз – хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей – через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода – сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18—20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Не все знают, что миелин – это множество слоев клеточной мембраны, много раз «намотанных» на аксон. Формируется миелин плоскими выростами «служебных» глиальных клеток, цитоплазма в которых практически отсутствует. Миелиновая оболочка не непрерывна, а дискретна, с промежутками (перехватами Ранвье). Поэтому аксон обладает более быстрой скачкообразной проводимостью: скорость прохождения сигнала по волокнам с миелином и без него может отличаться в сотни раз. Что касается молекулярного состава «изолятора», то он, как и все клеточные мембраны, состоит преимущественно из липидов и белков
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
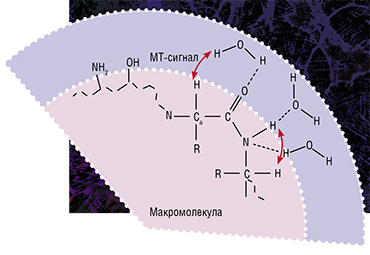
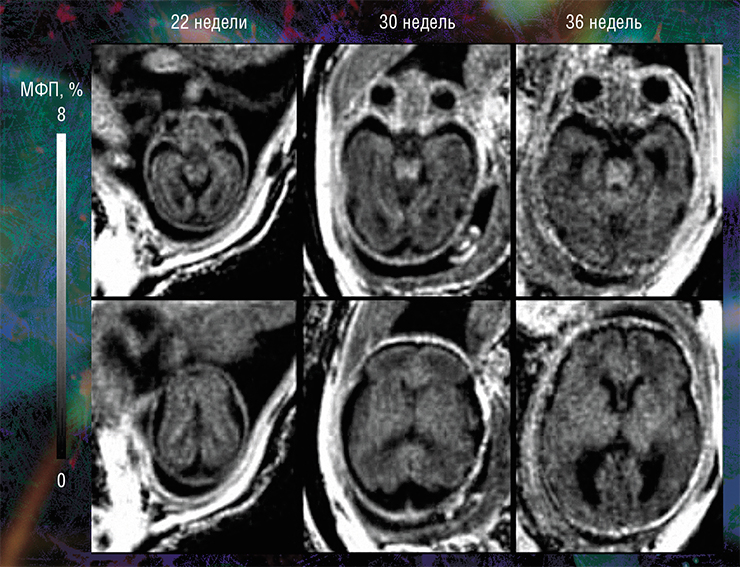
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) – биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин – в норме и патологии
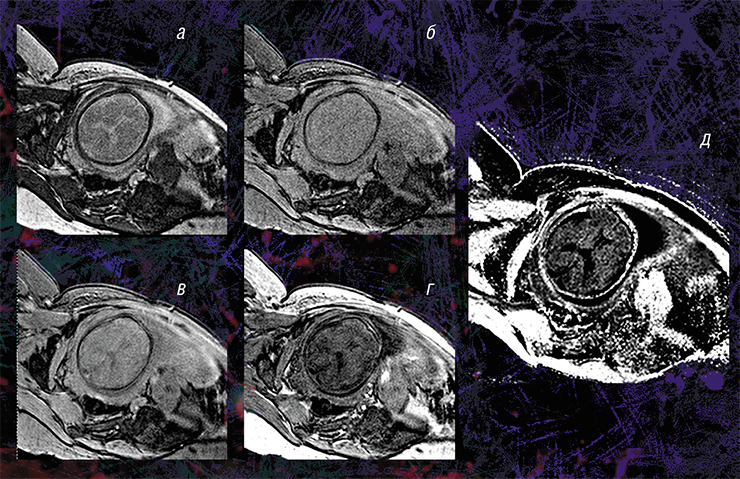
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
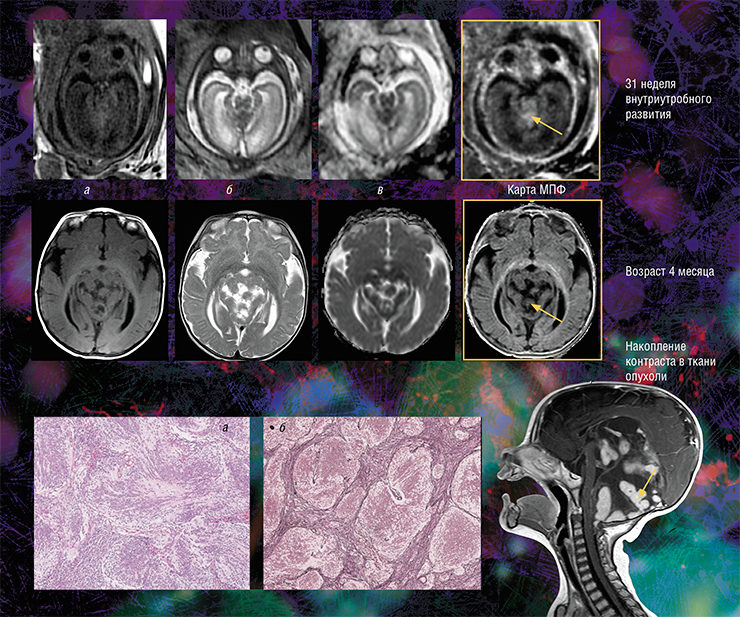
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы – врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635
Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH)
Источник