интродукция3 / katlinskyj_biotehnology
Государственное образовательное учреждение высшего профессионального образования Федеральное агентство по здравоохранению и социальному развитию
Московская медицинская академия им. И.М. Сеченова Фармацевтический факультет
Катлинский А.В., Сазыкин Ю.О., Орехов С.Н., Чакалева И.И.
КУРС ЛЕКЦИЙ ПО БИОТЕХНОЛОГИИ
Современная биотехнология в создании и производстве
Слагаемые биотехнологического процесса. Структура
Совершенствование биообъектов-продуцентов, используемых
в производстве лекарственных средств,
диагностических и профилактических препаратов
методами мутагенеза иселекции………………………………………………………… 25
Совершенствование биообъекта методами клеточной
Инженерная энзимология, которая основана на
иммобилизованных биообъектах: ферментахи целых клетках………… 53
Проблемы экологии. Биотехнологические аспекты
Рекомбинантные белки — инсулин, интерфероны, гормоны роста,
вакцины. Противоопухолевые антибиотики…………………………………………77
Регуляция внутриклеточных ферментативных реакций.
Механизмы внутриклеточной ферментации……………………………………… 99
Получение лекарственных средств на основе биотрансформации
Биотехнология в производстве витаминов…………………………………………..118
Получение лекарственных средств на основе культур клеток
растений методом биотехнологии………………………………………………………..124
Препараты на основе живых культур микроорганизмов-симбионтов
Геномика и протеомика. их значение для создания новых
СОВРЕМЕННАЯ БИОТЕХНОЛОГИЯ В СОЗДАНИИ И ПРОИЗВОДСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ.
1. Роль биотехнологии в современной фармации
2. Определение понятия биотехнологии
3. Краткая историческая справка по развитию биотехнологии в мире
4. Субстанции, используемые для биотехнологии
5. Биосинтез биологически активных веществ (БАВ) в условиях биотехнологического производства (общие положения)
5.1.Необходимые условия для биосинтеза 5.2.Параметры биотехнологического процесса, влияющие на биосинтез 5.3.Виды процессов биосинтеза
Современный провизор должен знать биотехнологию в рамках своей профессии, работая на отечественном рынке лекарственных средств, тесно интегрированным с мировым производством лекарственных препаратов.
Номенклатура лекарственных препаратов, полученных на основе биообъектов в силу объективных причин имеет тенденцию к своему расширению. В категорию таких лекарственных препаратов входят:
1. лекарственные средства для лечения, в число которых входят аминокислоты и препараты на их основе, антибиотики, ферменты, коферменты, кровезаменители и плазмозаменители, гормоны стероидной и полипептидной природы, алкалоиды;
2. профилактические средства, в число которых входят вакцины, анатоксины, интерфероны, сыворотки, иммуномодуляторы, нормофлоры;
3. диагностические средства, в число которых входят ферментные и иммунные диагностикумы, препараты на основе моноклональных антител и иммобилизованных клеток.
Это далеко не полный перечень лекарственных препаратов, которые имеются в современной фармации, в основе производства которых используются биообъекты.
Что касается определения самого понятия биотехнологии, то оно следует из понятия самой технологии. Технология – это наука о развитии естественных процессов в искусственных условиях. Если эти процессы относятся к
биосинтетическим или биокаталитическим, присущих клеткам прокариот и эукариот, когда в качестве элементной базы используются биообъекты для получения целевого (конечного) продукта, то такое производство называют биотехнологическим. Если же в роли целевого (конечного) продукта выступает лекарственное средство, то такая биотехнология называется «биотехнология лекарственных средств».
В настоящее время фармацию характеризует как минимум третья часть лекарственных средств от общего объема производимых лекарств, которая использует современные биотехнологии. Суммируя все позиции определения биотехнологии, указанные выше, можно сказать, что « Биотехнология – это
направление научно-технического прогресса, использующее биологические процессы и агенты для целенаправленного воздействия на природу, а также для промышленного получения полезных для человека продуктов, в том числе лекарственных средств».
Биотехнология – комплексная наука, это и наука и сфера производства со своим специфическим аппаратным оформлением. Биотехнология как
сфера производства – это наукоемкая технология.
Биообъект – это продуцент, биосинтезирующий нужный продукт, либо катализатор, фермент, который катализирует присущую ему реакцию.
Биотехнология использует либо продуценты – микроорганизмы, растения, высшие животные, либо использует изолированные индивидуальные ферменты. Фермент иммобилизируется (закрепляется) на нерастворимом носителе, что позволяет его использовать многократно.
Современная биотехнология использует такие достижения, как искусственные культуры клеток и тканей. Особое достижение биотехнологии – это генноинженерные продуценты, микроорганизмы, имеющие рекомбинантные ДНК. Ген четко изолируется и вводится клеткам микроорганизма. Этот микроорганизм будет продуцировать вещество, структура которого закодирована во введенном гене.
В истории развития биотехнологии можно выделить три основных периода:
1. эмпирическая биотехнология (тысячелетия). Самый первый биотехнологический процесс, осуществленный человеком – получение пива, был изобретен шумерами приблизительно 5 тысяч лет назад;
2. научная биотехнология (с Пастера);
3. современная биотехнология.
Биотехнологию можно условно разделить на три категории по получаемым продуктам:
1. природны е биотехнологические продукты, вырабатываемые собственно микроорганизмами (например, антибиотики);
2. биотехнологические продукты второго поколения , полученные с помощью генноинженерных штаммов (например, человеческий инсулин);
3. биотехнологические продукты третьего поколения – продукция XXI века, основана на изучении взаимодействия биологически активных веществ и рецепторов клеток и создании принципиально новых препаратов. Примером таких препаратов могут быть антисмысловые нуклеиновые кислоты . В клетке человека приблизительно 100 тысяч генов. Используя принцип комплементарности можно создать цепь нуклеиновых кислот, которые могут выключать тот или иной ген, что
позволяет с помощью антисмысловых нуклеиновых кислот управлять генами, корректируя обмен.
Биотехнология в зарубежных странах.
Первое место в мире по выпуску биотехнологической продукции занимает США, которая ежегодно выделяет 3 млрд. долларов на поддержку фундаментальных исследований в области медицины, из которых 2,5 млрд. долларов относится к области биотехнологии. Второй страной по выпуску биотехнологической продукции является Япония, третье место за Израилем.
Современная биотехнология – это наука, которая на практике использует достижения современных фундаментальных наук, таких как:
1. молекулярная биология
2. молекулярная генетика
3. биоорганическая химия.
Начиная с первых шагов и до наших дней технология изготовления лекарственных средств предусматривает использование субстанций, получаемых из разных источников. Это
— ткани животных или растений
Первый путь (использование тканей животных или растений) предполагает сбор дикорастущих лекарственных растений. Это, прежде всего, плантационное культивирование растений. Это также выращивание каллусных и суспензионных культур. Это наиболее современные методы культивирования клеток, в геном которых встроены опероны, ответственные за биосинтез лекарственной субстанции, то есть генная инженерия.
Можно привести пример такого растения как женьшень при извлечении из него панаксозидов, как биологически активного вещества:
-в естественных условиях, в дикорастущем виде, сбор такого растения может производится только на шестидесятом году его роста; -в условиях его выращивания на плантациях – на шестом году его произрастания;
-в каллусной культуре, то есть в культуре клеток растительной ткани панаксозиды можно извлекать в достаточном количестве, обеспечивая рентабельность производства уже на 15-25-тый день роста культуры ткани. Второй и третий путь получения лекарственных субстанций из неживой природы или путем химического синтеза раньше рассматривали в качестве конкурентного пути для биотехнологии. Жизнь внесла коррективы в это положение. Например, если мы говорим о возможностях перевода сорбита в сорбозу, или ситостерина в 17-кетоандростаны, или фумаровой кислоты в аспарагиновую и т.д., то в этих случаях биотехнология успешно конкурирует с тонкими химическими технологиями на отдельных этапах изготовления лекарственных средств, а в ряде случаев, например, при синтезе витаминав В 12 биотехнология может обеспечить всю последовательность сложных химических реакций, необходимых для превращения исходного предшественника (5,6 диметилбензимидазола), в конечный продукт – цианокобаламин.
Конечно, в последнем случае, когда всю технологическую цепочку осуществляет биообъект, находящийся в искусственных условиях, то он должен иметь условия наибольшего (максимального) благоприятствования (комфорта), что в свою очередь, предполагает обеспечение биообъекта необходимыми источниками питания, защиту от внешних неблагоприятных воздействий. Не менее важную роль в работе биообъекта играет и инженерно-техническая база, то есть процессы и аппараты биотехнологических производств.
В заключение можно сказать, что современная биотехнология функционирует с одной стороны на достижениях -биологии, -генетики, -физиологии, -биохимии,
-иммунологии и, конечно, биоинженерии, а с другой стороны, на совершенствовании самой технологии получения лекарственных средств, имея в виду:
-способы подготовки сырья, -способы стерилизации оборудования и всех потоков системы,
обеспечивающий — процесс получения биологически активных веществ, -способы оперативного контроля и управления биотехнологическими процессами.
Сегодня бизнес в области лекарственных средств, чтобы выстоять в конкуренции огромного числа производителей лекарственных средств, предполагает знания специалиста в области не только применения, но и получения медицинских препаратов на основе как тонкой химической технологии, так и биотехнологии.
Сферой интересов специалиста, работающего на рынке лекарственных средств являются следующие разделы биотехнологии:
1. Общая биотехнология лекарственных средств 1.1.биообъекты как средства производства 1.2.особенности процессов биосинтеза
2. Основные процессы и аппараты биотехнологического производства.
3. Частная биотехнолгия лекарственных средств
3.1.получение наиболее распространенных групп лекарственных средств, 3.2.новейшие биотехнологии с использованием генной инженерии
4. Экономические, правовые и экологические аспекты биотехнологического производства лекарственных средств.
Биосинтез БАВ (биологически активные вещества) в условиях производства.
1. Создание стерильных условий для биосинтеза
Биосинтез БАВ – это многостадийный процесс. Для успешного осуществления биосинтеза необходимо использовать простерилизованный воздух, стерильную питательную среду и оборудование.
Источник
Карабинцева Фармацевтическая технология методички / Краткий курс биотехнологии
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
ФЕДЕРАЛЬНОГО АГЕНТСТВА ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ»
Г. П .Трошкова, Н. О. Карабинцева, Г. Р.Денисова
КРАТКИЙ КУРС БИОТЕХНОЛОГИИ
УДК 631.147(075) ББК 30.16я73
Рекомендовано ЦМК по фармации в качестве учебного пособия
заведующая кафедрой фармакогнозии с курсом ботаники ГОУ ВПО «Новосибирский государственный медицинский университет Росздрава», доктор фармацевтических наук, профессор М.А.Ханина ;
заведующая кафедрой медицинской биологии ГОУ ВПО «Новосибирский государственный медицинский университет
Росздрава», доктор биологических наук, профессор Н. Т. Ясакова
Т70 Краткий курс биотехнологии : учеб. пособие / Г. П. Трошкова, Н. О. Карабинцева, Г. Р. Денисова. — Новосибирск : Сибмедиздат НГМУ, 2008 — 152 с.
Учебное пособие предназначено для студентов фармацевтического факультета очной и заочной формы обучения. В пособии приведены информационные материалы по основным вопросам фармацевтической технологии. Дополняет текст большое число иллюстраций. Материал изложен в соответствие с утвержденной программой. Пособие содержит учебные и контрольные вопросы по темам.
УДК 631.147(075) ББК 30.16я73
© Г. П. Трошкова, Н. О. Карабинцева, Г. Р. Денисова, 2008
Рабочая программа по биотехнологии для студентов фармацевтического
II. МАТЕРИАЛЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Биотехнология. История развития. Биотехнология лекарственных
Биологические системы, используемые в биотехнологии. Совершен-
ствования биообъектов методами мутагенеза и селекции . . . . . . . . . . . . . . . . . .
Создание продуцентов новых лекарственных веществ с помощью
методов клеточной и генетической инженерии . . . . . . . . . . . . . . . . . . . . . . . . . .
Геномика и ее значение для поиска новых лекарственных средств.
Культуры растительных клеток и получение лекарственных веществ . . . . . . .
Общая характеристика биотехнологического процесса . . . . . . . . . . . . . . . . . . .
Рекомбинантные белки и полипептиды. Традиционные и генно-ин-
Тема 1 0 . Иммунобиотехнология. Иммунные сыворотки . . . . . . . . . . . . . . . . . . . . . . . . .
1 1 . Биотехнология при решении проблем экологии и ликвидации антро-
погенных воздействий на окружающую среду . . . . . . . . . . . . . . . . . . . . . . . . . .
1 3 . Лекарственные препараты на основе первичных метаболитов . . . . . . . . . . . .
Контрольные вопросы по биотехнологии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 133
Рекомендуемая литература. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 150
Биотехнология — промышленное использование биологических процессов и агентов на основе получения высокоэффективных форм микроорганизмов, культур клеток и тканей растений и животных с заданными свойствами.
Биотехнология считается одним из самых перспективных направлений в науке и технике в ХХ и XXI веках. Биотехнология — отрасль будущего, которая сформировалась как междисциплинарная область научно-технического прогресса. Возникла она на стыке биологических, химических, технических, медицинских и фармацевтических дисциплин.
Данное учебное пособие «Краткий курс биотехнологии» создано на базе лекций, читаемых студентам фармацевтического факультета. Цель пособия — показать использование принципов биотехнологии в производстве лекарственных препаратов.
В пособии изложены традиционные и новейшие технологии, основанные на клеточной и генной инженерии. Рассмотрены такие методы, как рекомбинантной ДНК, культивирование клеток и тканей, клонирование и др.
Значительное внимание уделено биотехнологическому производству и его структуре. Обобщены достижения биотехнологии в решении экологических проблем.
Издание содержит необходимый материал для студентов фармацевтического факультета очной и заочной формы обучения. По каждой теме сформулированы основные вопросы, раскрываемые во время лекции, приведены контрольные вопросы.
Оно построено таким образом, что им удобно пользоваться во время чтения лекций и подготовки к занятиям, вносить какие-либо изменения и дополнения в лекционный курс.
По каждой теме даются ссылки на работы, в которых представлен оригинальный материал.
В конце курса дан биотехнологический словарь, облегчающий понимание и работу с текстом лекции.
Рабочая программа по биотехнологии для студентов фармацевтического факультета
Основная цель для изучающих данную дисциплину — это формирование системных знаний, умений и практических навыков по разработке, изготовлению, контролю качества лекарственных препаратов в условиях аптек и малых, средних, крупных фармацевтических предприятий. Цели изучения фармацевтической технологии и уровень требований полностью соответствуют стандарту.
Задачи биотехнологии как профильной учебной дисциплины следующие:
— ознакомить студентов с деятельностью провизора, исходя из знания основ молекулярной биологии и генетики продуцентов, методами генетической инженерии и инженерной энзимологии, дать знания фундаментальных основ методов контроля качества и подлинности препаратов, получаемых биотехнологическими методами;
— сформировать у студентов практические навыки изготовления биотехнологических лекарственных препаратов, умения оценить качества сырья, питательных сред, полупродуктов и целевых продуктов;
— выработать у студентов способности правильно оценивать соответствие биотехнологического производства правилам GMP, требованиям экологической безопасности, применительно к используемым на производстве биообъектам, т. е. продуцентам и целевым продуктам. Выработка правильной ориентации при оценке рекомбинантных белков как лекарственных препаратов;
— выработать у студентов умения и навыки пользования иммуноферментными и радиоиммунными методами определения биологически активных веществ.
Студент должен иметь представление:
1) об основных направлениях развития биотехнологии;
2) о технико-экономических особенностях биотехнологических процессов;
3) о ресурсах природных биоценозов как источника биологически активных веществ;
4) об эволюции биосферы в результате антропогенной деятельности и о путях воздействия на этот процесс.
Студент должен знать:
1) современные достижения фундаментальных биологических наук и биомедицинских технологий;
2) концепцию видоспецифичности лекарственных веществ;
3) принципы комбинаторной химии;
4) инновационные пути создания лекарственных веществ на основе использования геномики, протеомики и биоинформатики;
5) основные нормативные документы, относящиеся к производству, контролю качества, соблюдению экологической безопасности, хранению, международным и отечественным стандартам применительно к получаемым биотехнологическими методами лекарственных средств,
а также к биообъектам и их продуцентам.
Студент должен уметь:
1) определять доброкачественность микроорганизмов-продуцентов методом микроскопии, определяя концентрации жизнеспособных клеток и их ферментативной активности. Обеспечивать требуемые условия хранения промышленных штаммов;
2) учитывать влияние биотехнологических факторов на эффективность технологического процесса и качество конечного продукта;
3) поддерживать оптимальные условия для биосинтеза целевого продукта и решать ситуационные задачи при отклонениях от этих условий;
4) обеспечивать условия асептического проведения технологического процесса;
5) оценивать применяемые на производстве и в лаборатории методы работы с рекомбинантными штаммами;
6) проводить выделение и очистку лекарственных веществ из биомассы и культуральной жидкости;
7) осуществлять постадийный контроль и стандартизацию получаемых препаратов (определение антимикробной активности антибиотиков, активности ферментных препаратов, жизнеспособности микроорганизмов);
8) получать готовые лекарственные формы и диагностические препараты (наборы) из лекарственных веществ микробиологического происхождения;
9) осуществлять анализ биологически активных соединений методом иммуноферментного анализа;
10) проводить исследования по совершенствованию биотехнологического процесса;
11) информировать врачей лечебно-профилактических учреждений о лечебных и диагностических препаратах (тест-системах);
12) выбирать оптимальные условия хранения лечебно-диагностических препаратов и оценивать их качество в процессе длительного хранения;
13) обеспечивать соблюдение правил промышленной гигиены, охраны окружающей среды, охраны труда и техники безопасности.
Студент должен иметь навыки:
1) практической работы с НТД: лабораторными, опытно-промышленными регламентами;
2) определения биологической активности антибиотиков, витаминов, гомонов, рекомбинантных белков и иммунобиопрепаратов;
3) эксплуатации биореакторов и корректирования технологических параметров стандартизации.
I. СОДЕРЖАНИЕ КУРСА
1. Общая биотехнология
1.1. БИОТЕХНОЛОГИЯ КАК НАУКА И СФЕРА ПРОИЗВОДСТВА
Современная биотехнология как одно из основных направлений научно-технического про-
гресса . Биотехнологизация народного хозяйства. Биотехнология и энергетика. Биотехнология и природные ресурсы. Применение биотехнологических методов в горнодобывающей, нефтедобывающей и нефтеперерабатывающей промышленности. Химическая технология и биотехнология. Комбинирование биосинтеза и оргсинтеза при многостадийном получении полупродуктов и целевых продуктов. Биотехнология и новые методы анализа и контроля. Биосенсоры. Биодатчики. Новые материалы (биополимеры и др.), получаемые биотехнологическими методами.
Биотехнология и интенсификация сельскохозяйственного производства . Повышение продуктивности сельскохозяйственных растений и животных. Новые методы культивирования растений. Новые виды кормов. Биотехнология и пищевая промышленность. Совершенствование путей переработки сельскохозяйственных продуктов. Новые разновидности пищевых продуктов.
Пути решения проблем экологии и охраны окружающей среды методами биотехнологии.
Переработка и утилизация промышленных отходов. Очистка промышленных стоков. Биодеградация ксенобиотиков.
Биотехнология и медицина. Получение биотехнологическими методами лекарственных, профилактических и диагностических препаратов. Биотехнология и понимание основ патологии инфекционных, онкологических и наследственных заболеваний.
Биообъекты как средство производства лекарственных, профилактических и диагностических препаратов. Классификация биообъектов.
Макробиообъекты животного происхождения. Человек как донор. Человек как объект иммунизации и донор. Млекопитающие, птицы, рептилии, рыбы, насекомые, паукообразные, морские беспозвоночные. Культуры тканей человека и других млекопитающих. Основные группы получаемых биологически активных веществ.
Биообъекты растительного происхождения . Дикорастущие, плантационные растения.
Водоросли. Культуры растительных тканей. Основные группы получаемых биологически активных веществ.
Биообъекты — микроорганизмы. Эукариоты (простейшие, грибы, дрожжи). Прокариоты (актиномицеты, эубактерии). Вирусы. Основные группы получаемых биологически активных соединений.
Биообъекты — макромолекулы с ферментативной активностью. Промышленные биока-
тализаторы на основе индивидуальных ферментов и мультиферментных комплексов. Биоконверсия (биотрансформация) при получении гормонов, простаноидов, витаминов, антибиотиков и других биологически активных веществ.
1.2. ГЕНЕТИЧЕСКИЕ ОСНОВЫ СОВЕРШЕНСТВОВАНИЯ БИООБЪЕКТОВ
Пути и методы , используемые при получении более продуктивных биообъектов и биообъектов с другими качествами, повышающими возможность их использования в промышленном производстве (устойчивость к инфекциям, рост на менее дефицитных средах, большее соответствие требованиям промышленной гигиены и т. д.).
Традиционные методы селекции. Вариационные ряды. Отбор спонтанных мутаций. Мутагенез и селекция. Физические и химические мутагены и механизм их действия. Классификация мутаций. Проблемы генетической стабильности мутантов по признаку образования целевого биотехнологического продукта.
Клеточная инженерия и использование ее методов в создании микроорганизмов и клеток растений, т. е. новых продуцентов биологически активных (лекарственных) веществ. Протопластирование и слияние (фузия) протопластов микроорганизмов и растений. Возможность межвидового и межродового слияния. Гибриды, получаемые после слияния протопластов и регенерации клеток. Слияние протопластов и получение новых гибридных молекул в качестве целевых продуктов. Протопластирование и активация «молчащих генов». Возможности получения новых биологически активных веществ за счет активации «молчащих генов». Методы клеточной инженерии применительно к животным клеткам. Гибридомы. Значение гибридом для производства современных диагностических препаратов.
Генетическая инженерия и создание с помощью ее методов продуцентов новых лекарственных веществ. Основные принципы технологии рекомбинантной ДНК. Внехромосомные генетические элементы, т. е. плазмиды и их функции у микроорганизмов, используемых в биотехнологических процессах. Основные физико-химические характеристики плазмид. Взаимодействие плазмид с геномом хозяина. Роль плазмидной и фаговой ДНК в генетическом конструировании продуцентов биологически активных веществ. Транспозоны и их использование в конструировании продуцентов. Направленный мутагенез (in vitro) и его значение при конструировании продуцентов.
Понятие вектора в генетической инженерии. Векторные молекулы на основе плазмидной
и фазовой ДНК. Химический синтез фрагментов ДНК. Методы секвенирования (определения последовательности нуклеотидов). Химический синтез гена.
Ферменты, используемые в генетической инженерии. Рестриктазы. Классификация и специфичность. Формирование «липких концов». Рестриктаза E. coli R1 и распознаваемая ею последовательность нуклеотидов. Лигазы и механизм их действия.
Последовательность операций при включении чужеродного гена в векторную молекулу. Перенос вектора с чужеродным геном в микробную клетку. Компетентные клетки.
Генетические маркеры. Методы идентификации и изоляции клонов с рекомбинантной ДНК.
Проблемы экспрессии чужеродных генов в микроорганизмах . Гены животной клетки; эк-
зоны, нитроны. Обеспечение возможности экспрессии генов млекопитающих в микробной клетке. Обратная транскриптаза.
Способы преодоления барьеров на пути экспрессии чужеродных генов. Стабилизация чужеродных белков (целевых продуктов) в клетке. Генетические методы, обеспечивающие выделение чужеродных белков в среду.
Микроорганизмы различных систематических групп: дрожжи, эубактерии, актиномицеты
и другие как хозяева при экспрессии чужеродных генов. Специифические проблемы генетической инженерии при создании новых продуцентов белковых веществ, первичных и вторичных метаболитов как целевых биотехнологических продуктов.
1.3. ИММОБИЛИЗОВАННЫЕ БИООБЪЕКТЫ В УСЛОВИЯХ ПРОИЗВОДСТВА
Инженерная энзимология и повышение эффективности биообъектов (индивидуальных ферментов, ферментных комплексов и клеток продуцентов) в условиях производства. Иммобилизованные (на нерастворимых носителях) биообъекты и их многократное использование. Ресурсосбережение. Экологические преимущества. Экономическая целесообразность. Повышение качества препаратов лекарственных веществ (гарантия высокой степени очистки, отсутствия пирогенных, аллергенных примесей).
Нерастворимые носители органической и неорганической природы. Микроструктура носителей.
Иммобилизация за счет образования ковалентных связей между ферментом и носите-
лем. Предварительная активация носителя бромистым цианом. Механизм активации. Ковалентные связи с помощью бифункциональных реагентов между молекулами фермента, свя-
занного с носителем. Влияние иммобилизации ферментов на их субстратный спектр и кинетические характеристики. Повышение стабильности. Расширение зоны оптимальной температуры. Причины указанных явлений.
Адсорбция ферментов на инертных носителях и ионообменниках. Причины частичных ограничений использования этого метода иммобилизации.
Иммобилизация ферментов путем включения в структуру геля. Органические и неорганические гели. Методы включения в альпшатный и полнакриламидный гель. Причины частичных ограничений использования метода при высокомолекулярных субстратах.
Микрокапсулирование ферментов как один из способов их иммобилизации. Размеры и состав оболочки микрокапсул.
Биокатализ в тонком органическом синтезе . Использование иммобилизованных фермен-
тов при производстве полусинтетических бета-лактамных антибиотиков, трансформации стероидов, биокаталитическом получении простаноидов, разделении рацематов аминокислот.
Иммобилизованные ферменты и лечебное питание . Удаление лактозы из молока с помо-
щью иммобилизованной бета-галактозидазы. Превращение глюкозы во фруктозу с помощью иммобилизованной глюкоизомеразы.
Ферментные электроды на основе иммобилизованных ферментов: глюкозооксидазы, лактатдегидрогеназы, уреазы, пенициллиназы.
Иммобилизация целых клеток микроорганизмов и растений . Моноферментные биоката-
лизаторы на основе целых клеток. Внутриклеточная регенерация коферментов. Проблемы диффузии субстрата в клетку и выхода продукта реакции. Повышение проницаемости оболочки у иммобилизуемых клеток.
Полный синтез целевого продукта иммобилизованными клетками продуцентов. Использование для иммобилизации клеток в наиболее продуктивной фазе ростового цикла. Особенности физиологии клеток, находящихся в ячейках геля. Перспективы использования «плюс» вариантов продуцентов после протопластирования и регенерации мицелия.
Создание биокатализаторов второго поколения на основе одновременной иммобилиза-
ции продуцентов и ферментов трансформации продукта биосинтеза. Объединение в одном реакторе процесса биосинтеза и реакции трансформации. «Открытые системы для усложнения». Биореакторы различных типов.
1.4. ВНУТРИКЛЕТОЧНАЯ РЕГУЛЯЦИЯ МЕТАБОЛИЗМА И УПРАВЛЕНИЕ БИОСИНТЕЗОМ
Механизмы внутриклеточной регуляции и биосинтез целевых биотехнологических продуктов.
Индукция и репрессия синтеза ферментов . Состав оперона. Механизмы регуляции действия генов и их использование в биотехнологических процессах.
Ингибирование ферментов биосинтеза по принципу обратной связи (ретроингибирова-
ние). Механизм ретроингибирования. Аллостерические ферменты. Значение этого механизма в регуляции жизнедеятельности клетки и пути преодоления ограничений биосинтеза целевых продуктов у суперпродуцентов.
Аминокислотный контроль метаболизма и функции гуанозинтетрафосфата. Адаптация к меняющимся условиям среды и механизм строгого («STRINGENT») контроля. Биосинтез различных целевых биотехнологических продуктов и роль системы регуляции метаболизма, обусловленной гуанозинтетрафосфатом.
Катаболитная репрессия . «Глюкозный эффект» и подавление синтеза катаболических ферментов. Транзиентная репрессия. Исключение индуктора. Катаболитное ингибирование. Механизм катаболитной репрессии.
Регуляция усвоения азотсодержащих соединений . Ключевые соединения в биосинтезе азотсодержащих соединений. Ферменты синтеза глутамата и глутамина. Понятие кумулятивного ретроингибирования.
Внутриклеточный транспорт и секреция биотехнологических продуктов у микроорганизмов. Структура и видовая специфичность оболочки. Роль клеточной стенки, внешней и
внутренней мембраны. Биосинтез полимеров оболочки. Литические ферменты. Мембранные системы транспорта ионов и низкомолекулярных метаболитов. Классификация систем транспорта. Регуляция их функций. Биотехнологические аспекты интенсификации транспорта низкомолекулярных веществ в клетку и освобождения из клетки. Механизмы секреции высокомолекулярных биотехнологических продуктов. Фосфорный обмен и энергообеспечение. Биотехнологические аспекты секреции.
«Суперпродуценты» и механизмы защиты клетки от образуемого ею продукта в случае его токсичности (suicide). Компартментация. Мультиферментные комплексы. Обратимая инактивация и реактивация во время выброса и среду. Непроницаемость клеточной мембраны продуцента для экзогенного suicide. Природная нечувствительность продуцента к большому количеству образуемого им целевого биотехнологического продукта за счет отсутствия внутриклеточных мишеней. Образование целевого продукта на поздней стадии роста продуцента с ослаблением чувствительности клеток к целевому продукту.
Сохранение свойств промышленных штаммов микроорганизмов — продуцентов лекар-
ственных веществ. Проблемы стабилизации промышленных штаммов. Причины нестабильности суперпродуцентов. Способы поддержания активности. Международные и национальные коллекции культур микроорганизмов и их значение для развития биотехнологии. Банки данных о микроорганизмах, растительных и животных клетках и отдельных штаммах микроорганизмов.
2. Биотехнологические системы производства
2.1. УСЛОВИЯ, НЕОБХОДИМЫЕ ДЛЯ РАБОТЫ БИООБЪЕКТОВ
Условия, необходимые для работы биообъектов в биотехнологических системах про-
изводства лекарственных средств . Основные «варианты» биотехнологий. Биотехнологический процесс как базовый этап, обеспечивающий сырье для получения лекарственных, профилактических или диагностических препаратов. Биотехнологический процесс как промежуточный или заключительный этап производства препарата. Биотехнологический процесс, обеспечивающий все стадии создания лечебного, профилактического, диагностического препаратов.
Общие основы экзогенной регуляции продуктивности макро- и микрообъектов. Жизнеобеспечение макроорганизмов — животных и высших растений как источника биомассы (различных тканей). Жизнеобеспечение микроорганизмов как источника биомассы. Защита от контаминации. Предотвращение выброса в окружающую среду. Техногенная экологическая ниша для существования микрообъектов в монокультуре.
Жизнеобеспечение культур клеток высших растений и животных. Защита от контаминации. Ауксины. Цитокинины. Индукторы митотического цикла.
Проблемы лизогении и онкогенов при культивировании биообъектов. Обеспечение эффективной работы биообъектов, используемых как промышленные биокатализаторы. Подбор реакционных смесей. Инженерные решения.
Сочетание условий для поддержания жизнеобеспечения биообъекта и максимального синтеза целевого продукта при наиболее сложном варианте биотехнологического процесса. Направленная регуляция состава питательной среды и воздействия физических факторов в течение ферментации. Предшественники целевого продукта и время их внесения в среду.
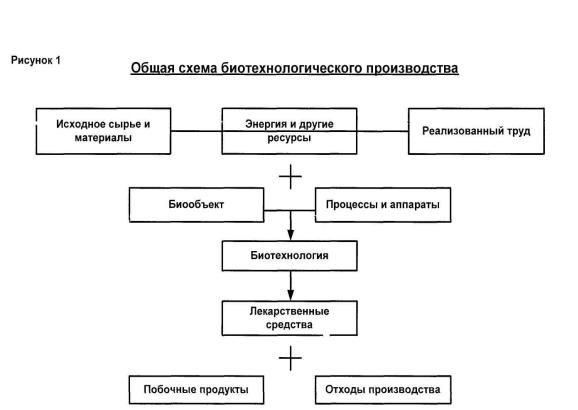
Слагаемые биотехнологического процесса производства лекарственных средств. Иерар-
хическая структура биотехнологического производства. Первая ступень построения: подсистемы типа биообъект — биореакторы, биомасса — сепараторы, экстракторы и т. п. Вторая ступень построения: объединение подсистем в функционально единую цепь (участок, цех). Технологические основы создания блочно-модульных типовых решений. Третья ступень построения: последовательность блоков и модулей функциональных участков. Опытнопромышленная установка, предприятие законченного цикла, основные и вспомогательные (общеинженерные) подсистемы.
Источник