Биологически активные вещества лекарственного растительного сырья эфирные масла
Последнее время арсенал фармацевтического рынка значительно расширился высокоэффективными лекарственными препаратами (ЛП) синтетического происхождения. Благодаря этому стали решаться проблемы социально значимых заболеваний сердечно-сосудистой и гепатобилиарной систем, различных инфекций. Но такие ЛП имеют целый ряд побочных эффектов, основные из которых токсичность и аллергические реакции. Симптоматическое применение природных биологически активных веществ позволяет снизить влияние побочных эффектов на организм синтетических ЛП. К числу наиболее традиционных объектов следует отнести эфирномасличные растения, которые на протяжении многих веков применялись не только как пряности и источники парфюмерной продукции, но и как лекарственные средства.
Эфирные масла (ЭМ) – летучие жидкие смеси органических веществ, вырабатываемые растениями и обусловливающие их запах. В состав эфирных масел входят углеводороды, спирты, сложные эфиры, кетоны, лактоны, ароматические компоненты и т.д. В настоящее время из эфирных масел выделено более 1000 соединений, что значительно расширило арсенал их использования [2]. ЭМ применяются часто в качестве вспомогательных веществ, как корригенты вкуса и запаха в производстве фармацевтических продуктов, но в качестве фармацевтических субстанций не так распространены, хотя исследования показали, что ЭМ обладают разнообразными фармакологическими свойствами [3; 4].
Цель исследования. Выявить перспективные эфирные масла для внедрения в медицинскую практику в качестве фармацевтической субстанции.
На первом этапе нами изучен состав лекарственных препаратов (ЛП) с эфирными маслами, представленных на отечественном фармацевтическом рынке (табл. 1).
В результате анализа выявлено, что в состав ЛП наиболее часто входят эфирные масла, основным компонентом которых являются монотерпены. Наиболее распространенными в составе лекарственных препаратов являются: масло эвкалипта, шалфея и мяты, содержащие в своем составе такие моноциклические монотерпены, как цинеол, ментол.
Мировой ассортимент основных эфиромасличных растений насчитывает порядка 30-40 видов. Важнейшими среди них являются виды следующих родов: Citrus Abies, Coriandrum, Juniperus, Rosa, Geranium и др., в состав которых входят не только моноциклические монотерпены, но и их предшественники ациклические монотерпены: гераниол, линалоол, цитронеллол и др. [8]. Это показывает актуальность исследований в данном направлении и возможность расширения ассортимента лекарственных средств с эфирными маслами.
Ассортимент лекарственных препаратов, содержащих эфирное масло
Класс соединений [6]
транс-анетол (84-93%), цис-анетол, метилхавикол, анисовый альдегид и др.
Доктор Тайсс Анисовое масло
эвгенол (более 70%), ацетат эвгенола (до 13%), кариофиллен и др.
тимол (до 50%), карвакрол, геранилацетат
коричный альдегид (не менее 80%), бензальдегид
линалоол (30-35%), мирцен, α- и β-оцимены
α-лимонен (до 90%), цитраль, геранилацетат и др.
Лимонные пастилки от кашля Доктор-МОМ
Стрепсилс, таблетки для рассасывания медово-лимонные
Ментол (до 90%), α- и β-пинен, дипентен, фелландрен, цинеол и др.
Доктор Тайсс Анги Септ
Стрепсилс, таблетки для рассасывания медово-лимонные
мирцен, цис- и транс-β-оцимены, дипентен, α- и γ-терпинены и др.
Розеол, гераниол, цитронеллол
α- и β-пинены (30%), камфен (20%), борнеол, цинеол, камфора
α- и β-пинены, кадинен, борнеол, борнилацетат
Туссамаг бальзам от простуды
Эвкабал Бальзам С
тимол (до 30%), карвакрол и др.
цинеола (около 15%), D-α-пинена, α- и β-туйона, D-борнеола и D-камфоры
моноциклические и бициклические монотерпены
анетол (50-60%), фенхон и др.
цинеол, D-пинен, камфен, фенхен, валериановый, масляный и капроновый альдегиды
Бронхикум бальзам с эвкалиптовым маслом
Доктор МОМ® Колд Раб
Доктор МОМ® Рабон
Санорин с маслом эвкалипта
Стрепсилс с ментолом и эвкалиптом
Туссамаг бальзам от простуды
Эвкабал Бальзам С
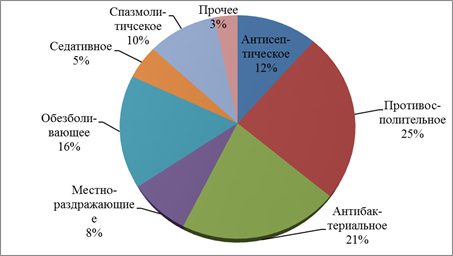
На следующем этапе нами изучено фармакологическое действие эфирных масел в составе ЛП (рис. 1). По основному проявляемому фармакологическому эффекту преобладают эфирные масла противовоспалительного 25% и антибактериального действия 21%, наиболее редко ЭФ используется в качестве седативных средств 8%.
В последние годы активно ведутся исследования по изучению специфической фармакологической активности эфирных масел можжевельника, чернушки посевной, розмарина и др. В Институте питания Республики Таджикистан изучены фармакологические свойства эфирного масла травы герани душистой и лимона. При этом установлено, что эфирное масло герани обладает желчегонным, противовоспалительным, гепатозащитным и спазмолитическим свойствами [1]. Исследования показали, что по эффективности гераниевое эфирное масло превосходит действие ЛП, таких как розанол, карсил, аллохол, холисал. Экспериментально показано, что эфирное масло лимона обладает выраженными гипогликемическими свойствами и снижает холестерин липопротеинов высокой плотности [1]. Выше сказанное показывает перспективность внедрения новых эфиромасличных растений в медицинскую практику.
Рис. 1. Распределение эфирных масел по фармакологическому действию.
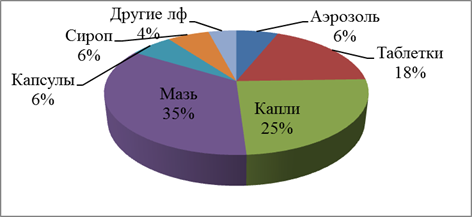
На следующем этапе работы изучены лекарственные формы эфирных масел, представленные на фармацевтическом рынке (рис. 2). Наиболее часто эфирные масла используются в мазях и каплях. Для расширения ассортимента лекарственных препаратов для перорального применения рационально использовать капсулы, в частности мягкие желатиновые капсулы, так как мягкие капсулы остаются одной из немногих ЛФ, способных сохранять и доставлять липофильные вещества в легкодоступной для организма форме – растворе.
Рис. 2. Лекарственные формы с эфирными маслами.
При использовании эфирного масла в качестве фармацевтической субстанции встает вопрос о стандартизации. До 1960-х гг. эфирные масла оценивали по таким классическим методам, как физические свойства (плотность, угол вращения поляризованного света, показатель преломления, температуры замерзания, плавления, кипения) и химические показатели (эфирное и кислотное число, эфирное число после ацетилирования). Стремительное развитие приборной и аналитической базы анализа органических соединений способствовало более детальному и тонкому анализу эфирных масел. Развитие хроматографических методов разделения и спектральных характеристик органических веществ, в том числе масс-спектрометрии, обеспечило возможность выделения и определения структуры природных соединений эфирных масел [5]. Это дает возможность для более точной стандартизации эфирных масел, содержащих в своем составе большое разнообразие соединений, обладающих биологической активностью.
Выводы
1. В качестве перспективных эфиромасличных растений для внедрения в медицинскую практику следует выделить траву герани душистой, кожуру плода лимона, плоды кориандра и можжевельника, семена чернушки посевной и др.
2. Актуальна разработка рациональных для перорального введения лекарственных форм эфирных масел, в частности мягких желатиновых капсул.
3. Для внедрения новых субстанций эфирных масел в медицинскую практику необходима стандартизация и разработка проекта фармакопейной статьи на субстанцию и лекарственную форму.
Рецензенты:
Олешко О.А., д.фарм.н., профессор кафедры фармацевтической технологии ГБОУ ВПО «ПГФА» Минздрава России, г. Пермь;
Белоногова В.Д., д.фарм.н., профессор, заведующая кафедрой фармакогнозии с курсом ботаники ГБОУ ВПО «ПГФА» Минздрава России, г. Пермь.
Источник
Биологически активные вещества лекарственного растительного сырья эфирные масла
Интерес к полыни однолетней (Artemisia annua L., Asteraceae) связан с выделением в 1970-х годах китайскими учеными высокоэффективного противомалярийного соединения – артемизинина. В настоящее время, по данным электронного ресурса Web of knowledge, общий объем научных работ при поиске по ключевым словам «Artemisia annua» составляет 1353, по данным РИНЦ, при поиске по ключевым словам «Artemisia annua» – 199, «полынь однолетняя» – 346 единиц, что свидетельствует об устойчивом интересе к этому виду. Прежде всего, он рассматривается в качестве составной части решения проблемы малярии, устойчивой к другим лекарствам [44]. Немаловажным является и то, что у артемизинина и родственных соединений обнаружена цитотоксическая активность, что позволяет их использовать в противораковой терапии [19]. Растение введено в государственную фармакопею Вьетнама и Китая [ 12 ].
Настоящий обзор посвящен биологически активным соединениям полыни однолетней и связан с поиском новых источников растительного сырья во флоре России, а также их химическим изучением с целью создания новых лекарственных средств отечественного производства.
Сесквитерпеновые лактоны полыни однолетней
Основным действующим веществом полыни однолетней является сесквитерпеновый лактон артемизинин и его производные. В промышленном масштабе артемизинин до настоящего времени получают экстракцией из сухих листьев полыни однолетней. Основным фактором ограничения производства артемизинина является его низкий уровень в растении. Выведено несколько сортов полыни однолетней, отличающихся высоким содержанием артемизинина, особенно выделяется сорт «Artemis», содержащий от 1 до 2 % на сухой вес [39]. Несмотря на то, что биосинтез артемизинина контролируется, главным образом, генетическими факторами [17], большое влияние оказывают и условия произрастания и агрономические приемы – пересадка растений, дренаж, плодородие и рН почвы, плотность посадки растений, введение бактериальных и грибковых систем в растения [13]. Проводятся также работы по созданию клеточных культуры полыни однолетней в нашей стране [5], за рубежом [26].
Основные производные артемизинина в растениях – это артеаннуин В, артемизининовая кислота, содержащиеся в листьях растений, из которых примерно 42 % от общего объема артемизинина, содержатся в верхних листьях [18]. Общая сумма артемизинина, выделенного из разных частей Аrtemisia annua, составляет около 0,01 и 1,4 % от сухой массы листьев. В некоторых частях растения артемизининовая кислота, является основным предшественником артемизинина, и находится в значительных концентрациях, при этом ее содержание почти на порядок выше, чем концентрация самого артемизинина [29]. Поэтому химическое преобразование артемизининовой кислоты является обязательным пунктом разработки полусинтетического маршрута получения артемизинина, увеличивая тем самым общий объем производства из биомассы [8]. В России разработана и валидирована методика количественного определения суммы секвитерпеновых лактонов в траве полыни однолетней в пересчете на артемизинин [1].
В 80-х годах ХХ века группой российских ученых было изучено содержание артемизинина в полыни однолетней и предприняты попытки его культивирования в ВИЛР (г. Москва) [10]. Из полыни однолетней, произрастающей на территории Бурятии (Россия), различными методами в ыделены экстракты, и показано, что содержание артемизинина в них может доходить до 0,054 % [40].
Эфирное масло полыни однолетней
Химическое исследование полыни однолетней в нашей стране было начато как исследование эфиромасличного растения. Никитский ботанический сад в Крыму провел серьезные работы по созданию промышленных сортов однолетней полыни для получения эфирного масла [2]. Выход масла составляет до 2,35 % [16], 0,49–0,81 % [23], 1,4–4,0 % [24], 0,05–0,4 % [8].
Состав эфирного масла дикорастущих форм полыни однолетней изменяется в зависимости от фазы развития [31, 27], места произрастания растения [3, 23, 32] и способа выделения [6]. Анализ литературных данных показывает, что в составе эфирного масла Artemisia annua L. из разных стран всегда присутствуют артемизиакетон, 1,8-цинеол, артемизиаспирт, камфора, a-пинен, b-кариофиллен. При этом они не всегда являются основными компонентами эфирного масла. Например, артемизиакетон указывается в качестве основного компонента в эфирных маслах из большинства стран (таблица), но не обнаружен в растениях из провинции Сычуань, из провинции Аба его всего 0,3 %, из провинции Цинхай – 15,9 % [32], во французских маслах – 2,8 % [25], в российских – до 47,97 % в фазу бутонизации (Крым, [27]), 10,2–25,8 % (Республика Бурятия, [3]).
Основные компоненты эфирного масла полыни однолетней из разных стран
Источник
Биологически активные вещества лекарственного растительного сырья эфирные масла
На современном этапе развития фармации, несмотря на очевидные успехи химического синтеза новых соединений, обладающих фармакологической активностью и являющихся основой производства новых лекарственных средств, не утрачивают своей актуальности фитопрепараты. Для производства всего ассортимента фитопрепаратов используется разнообразное лекарственное растительное сырье (ЛРС). Вполне естественно, что фармакологическая активность лекарственных средств растительного происхождения определяется комплексом биологически активных соединений (БАС), которые извлекаются из ЛРС в процессе получения субстанций или изготовления фитопрепаратов. Комплекс БАС в составе любого растения представлен разнообразными химическими соединениями, синтезируемыми в биохимических реакциях первичного и вторичного метаболизма.
В большинстве учебных материалов и в значительном количестве научных работ в классификации БАС растительного происхождения нет последовательности и единообразного подхода, зачастую преобладают архаизмы и устойчивые сленговые понятия.
Так, термин «сердечные гликозиды», широко используемый в учебной литературе стран СНГ [4, 5, 7, 9, 11], не имеет ничего общего с классификацией гликозидов по типу связи генина с агликоном. Соединения, которые относят к этому классу представляют собой типичные О-гликозиды, широко распространенные в растениях, а их агликоны имеют совершенно разную химическую структуру и тем более биогенетическое происхождение. Гликозидирование в известном смысле является способом транспортирования агликонов [19] по органам растений и в этой связи можно говорить только о форме существования агликона. Название «сердечные» или «кардиотонические» отражает фармакологическую активность подобных соединений, но и сумма флавоноидных гликозидов боярышника также обладает подобной активностью. При этом агликоны карденолидов имеют стероидный скелет, в то время как флавоноиды такого скелета не имеют.
В существующей классификации сапонинов выделяют тритерпеновые сапонины и стероидные сапонины [7, 9] или даже «тритерпеновые сапонины стероидного происхождения» [4]. Вместе с тем любые сапонины имеют своим биогенетическим предшественником тритерпеновое соединение сквален [12] и в этом случае все сапонины могут быть только тритерпеновой природы и различаются только структурой.
В.А. Куркин [3, 4] сделал попытку построить классификацию фенольных соединения, выделив в качестве «новой» группы соединений широко известный с середины 20-го века класс соединений [2, 14] – фенилпропаноидов, имеющих скелет С6–С3. В предложенной классификации [4] выглядит искусственным выделение таких групп, как «фенилпропаноиды фенилэтанового происхождения» и фенилпропанов – соединениий вида С6–С3, имеющие бескислородную боковую цепь С3 (эвгенол, анетол). Все фенольные соединения, за исключением нескольких соединений хиноидной структуры, синтезируются по схеме: шикимовая кислота → фенилаланин → фенилпропаноид и этот путь биосинтеза именуется фенилпропаноидным («phenylpropanoid pathway» [14, 16]). Фенилпропан по определению не может быть производным фенилпропаноида – только в обратном порядке. В то же время и эвгенол и анетол по своей химической структуре имеют ненасыщенную связь С=С и являются, таким образом, фенилпропенами, которые уже могут быть производными фенилпропаноидов. В случае же с «фенилпропаноидами фенилэтанового происхождения» перед нами просто олигосахариды, имеющие два разных агликона – фенилпропаноид и фенилэтаноид.
Автор [4] также вводит термины флаволигнаны и, по аналогии с ним, ксанто- и кумаринолигнаны. Термин флавонолигнан («flavonolignane») был предложен Р. Хенселем и А. Пельтером еще в 1968 году, хотя позднее они же признали неудачность данного термина, т.к. подобные соединения ничего общего с лигнанами не имеют [15]. Действительно лигнаны – это димеры монолигнолов [10], соединенных по принципу «хвост к хвосту», а неолигнаны по принципу «голова к хвосту» [18]. Номенклатура ИЮПАК [17] также не предусматривает введенных в [4] групп флаво-, ксанто-, и кумаринолигнанов, а класс неолигнанов – в понимании [4] не соответствует неолигнанам в общепринятой номенклатуре современной органической химии [17].
Выделение класса хинонов по принципу общности биосинтеза, сделанное в [4], также не обосновано т.к. синтез хинонов происходит по крайней мере тремя различными путями [10, 18]. Они могут быть объединены в отдельную группу только по принципу наличия в их структуре хиноидного ядра. В этом случае становится очевидным, что «антраценпроизводные соединения» [4, 7, 9, 11, 13] по сути не являются производными антрацена в том числе и потому, что в растениях сам антрацен не синтезируется. Один тип соединений, имеющий углеродный скелет антрацена, для обозначения которых может использоваться термин «антраценоид», образуются по поликетидному пути биосинтеза – 1,8-антрахинон (подгруппа хризацина) или в результате взаимодействия шикимовой и мевалоновой кислот – второй тип антраценоидов – 1,2-антрахинон (подгруппа ализарина).
На настоящий момент только классификация алкалоидов, созданная в середине прошлого века А.П. Ореховым, не потеряла своей актуальности и продолжает действовать после небольших уточнений в терминологии – в частности термин «алкалоиды с атомом азота в боковой цепи» [7, 11, 16] или используемый в [4] термин «экзоциклические алкалоиды» более терминологически правильно называть «изоциклическими» [1].
Отмеченные выше недостатки в используемых системах классификации природных БАС необоснованно затрудняют понимание и усвоение студентами курса фармакогнозии, т.к. разрывают логические связи с базовыми фундаментальными науками.
Деление метаболизма растений на «первичный» и «вторичный» в рассматриваемом контексте явно устарело т.к. не позволяет объяснить отнесение группы азотных соединений (аминокислот, а также витаминов, хлорофилла) – синтез которых может происходить в процессах вторичного метаболизма к БАС первичного метаболизма.
Решая подобную проблему, Дж. Харборн и П. Дей предложили [18] в первичном метаболизме рассматривать различные пути биосинтеза первичных метаболитов, таких как углеводы, липиды, аминокислоты, нуклеиновые кислоты, белки. В то же время для описания синтеза вторичных метаболитов авторы ввели понятие «специального метаболизма», в котором синтезируются фенолы, изопреноиды и вторичные азотсодержащие соединения (алкалоиды). Более целесообразно с позиций фармакогнозии и оправдано использование выделение в процессе биосинтеза БАС следующих типов метаболизма:
1. Углеводно-липидный метаболизм – здесь синтезируются (из БАС, рассматриваемых в курсе фармакогнозии) моно-, олиго и полисахариды, высшие жирные кислоты, липиды, а также, в цикле Кребса, карбоновые кислоты.
2. Азотный метаболизм – ассимиляция нитратов начинается в реакции с α-кетоглутаровой кислотой и первичным продуктом ассимиляции является глутамат [6, 18]. В дальнейшем перенос аминогруппы происходит в процессе переаминирования, а углеродные скелеты всего многообразия аминокислот формируются на различных стадиях циклов Кальвина и Кребса, а других азотсодержащих соединений – в процессе биосинтеза изопреноидных и фенольных соединений. Таким образом, в процессе азотного метаболизма синтезируются как первичные метаболиты – протеиногенные аминокислоты, так и вторичные метаболиты, которые включают наряду с алкалоидами, цианогенные гликозиды и непротеиногенные аминокислоты.
Источник