Система классификации биофармацевтики — Biopharmaceutics Classification System
Система классификации биофармацевтики — это система, позволяющая дифференцировать лекарственные средства на основе их растворимости и проницаемости.
Эта система ограничивает прогноз, используя параметры растворимости и кишечной проницаемости . Растворимость классификация основана на Фармакопеи США (USP) апертурой. Проницаемость кишечника классификация основана на сравнении с внутривенной инъекции . Все эти факторы очень важны, потому что 85% наиболее продаваемых лекарств в США и Европе вводятся перорально .
Содержание
BCS классы
В соответствии с Системой биофармацевтической классификации (BCS) лекарственные вещества классифицируются по четырем классам по их растворимости и проницаемости:
- Класс I — высокая проницаемость , высокая растворимость
- Пример: метопролол , парацетамол.
- Эти соединения хорошо всасываются, и скорость их абсорбции обычно выше, чем выведение.
- Класс II — высокая проницаемость, низкая растворимость
- Пример: глибенкламид , бикалутамид , эзетимиб , ацеклофенак.
- Биодоступности этих продуктов ограничена скоростью их сольватации. Может быть обнаружена корреляция между биодоступностью in vivo и сольватацией in vitro .
- Класс III — низкая проницаемость, высокая растворимость
- Пример: циметидин
- Абсорбция ограничена скоростью проникновения, но лекарство растворяется очень быстро. Если состав не изменяет проницаемость или продолжительность желудочно-кишечного тракта, тогда могут применяться критерии класса I.
- Класс IV — низкая проницаемость, низкая растворимость
- Пример: бифоназол
- Эти соединения имеют плохую биодоступность. Обычно они плохо всасываются слизистой оболочкой кишечника, и ожидается высокая вариабельность.
Определения
Препараты классифицируются в BCS на основе растворимости, проницаемости и растворения.
Границы класса растворимости основаны на максимальной дозе продукта с немедленным высвобождением. Лекарство считается хорошо растворимым, если самая высокая доза растворяется в 250 мл или меньше водной среды в диапазоне pH от 1 до 7,5. Расчетный объем в 250 мл получен на основе типичных протоколов исследования биоэквивалентности, которые предписывают введение лекарственного препарата натощак добровольцам-людям со стаканом воды.
Границы классов проницаемости косвенно основаны на степени абсорбции лекарственного вещества в организме человека и непосредственно на измерении скорости массопереноса через кишечную мембрану человека. В качестве альтернативы можно использовать нечеловеческие системы, способные предсказывать абсорбцию лекарств у людей (например, методы культивирования in vitro). Лекарственное вещество считается высокопроницаемым, если степень абсорбции у людей определяется как 90% или более введенной дозы на основании определения баланса массы или по сравнению с внутривенной дозой.
Для границ класса растворения продукт с немедленным высвобождением считается быстро растворяющимся, если не менее 85% указанного количества лекарственного вещества растворяется в течение 15 минут с использованием аппарата для растворения 1 Фармакопеи США при 100 об / мин или прибора 2 при 50 об / мин в объеме 900 об / мин. мл или меньше в следующих средах: 0,1 М HCl или имитирующая желудочная жидкость, или буфер с pH 4,5 и буфер с pH 6,8, или имитация кишечной жидкости.
Источник
Биофармацевтическая классификация лекарственных средств. Процедура «биовейвер».
Биофармацевтическая система классификации (BCS) представляет собой инструмент для разработки, который дает возможность оценить вклад трех фундаментальных факторов: растворение, растворимость и кишечную проницаемость, которые управляют скоростью и степенью поглощения субстанции из твердой дозированной пероральной лекарственной формы. Растворение препарата представляет собой процесс высвобождения действующего вещества, в результате которого это вещество становится доступным к всасыванию. Проницаемость же, в свою очередь, относится к способности молекулы субстанции проникать через мембрану в системный кровоток. БСК является также фундаментальным руководством для определения условий, при которых ожидается IVIVC и для разработки спецификаций in vitro растворения. БСК оперирует моделями растворения и абсорбции препарата, которые рассматриваются по ключевым параметрам, управляющим растворением препарата и его всасыванием, таким как: число всасывания, число растворимости и единица дозы.
- Число всасывания (An) — это отношение среднего времени удержания (Tres) к среднему времени абсорбции (Tabs).
- Число растворимости (Dn) — это отношение Tres к среднему времени растворения (Tdiss).
- Единица дозы (D0) — это отношение дозы к растворимости лекарственного средства.
Классификация БСК в сочетании с многочисленными фармакопейными и физиологическими средами растворения может использоваться как фундаментальное руководство для проектирования и создания соответствующих биорелевантных условий растворения, ведущих к более многозначительному прогнозированию in vivo действия.
Учитывая потенциал, заложенный в БСК, можно утверждать, что корректно разработанный тест на растворение может быть ключевым прогнозирующим инструментом в оценке как возможности использования препаратов для орального приема, так и проведения биоэквивалентности их технологических прописей.
ПРОЦЕДУРА «БИОВЕЙВЕР»
Продолжительность и высокая стоимость (до 2 млн руб.) испытаний in vivoдля определения биоэквивалентности дженериков обосновывают актуальность внедрения сравнительных испытаний in vitro по так называемой процедуре «биовейвер» [19, 48].
«Биовейвер» (biowaiver) – процедура, в соответствии с которой определение взаимозаменяемости и регистрация дженериков проводится на основании их биофармацевтических свойств и эквивалентности in vitro, как альтернатива исследованиям биоэквивалентности in vivo [7, 19, 113]. Процедура «биовейвер» может быть использована также при проведении маркетинговых исследований ЛС [114, 115, 116].
Регуляторную процедуру «биовейвер» допускают НД FDA (2000 г.) [36, 62], ВОЗ (2006 г.) [23], Агентство по фармацевтической продукции и медицинским приборам (PMDA) (2006 г.) [115, 116], Минздрав Украины (2007 г.) [21], ЕМА (2010 г.) [22].
Возможность проведения процедуры зависит от определенных условий. Это должна быть твердая ЛФ немедленного высвобождения системного действия [19]. ФС должна обладать широким терапевтическим индексом, относиться к I, II илиIII классу по БКС. ВВ, входящие в состав исследуемых ЛП, не должны влиять на высвобождение ФС при проведении испытаний.
Учитываются и свойства ЛП. В зависимости от скорости растворения ФС из ЛП последние делятся на быстрорастворимые и медленно растворимые (по FDA[36]) или очень быстрорастворимые, быстрорастворимые и остальные (по ВОЗ[23]). ЛП считается очень быстрорастворимым, если не менее 85% активной субстанции переходит в среду растворения за 15 мин при испытании на ЛМ (75 об/мин) или ВК (100 об/мин) в каждом из буферных растворов с рН 6,8; 4,5 и 1,2, объемом 900 мл. ЛП считается быстрорастворимым, если в этих же условиях не менее 85% ФС переходит в среду растворения уже за 30 мин.
Рекомендательные документы ВОЗ [23], FDA [36], ЕМА [22] содержат ряд одинаковых положений: гармонизированные монографии по растворению; использование одинаковых аппаратов (ВК и/или ЛМ); допустимость процедуры «биовейвер» для ЛП с ФС I класса; особые требования к ФС с узким терапевтическим индексом; расчет коэффициента подобия как критерия подобия профилей растворения; совпадение одной среды растворения; тестирование 12 единиц ЛП [117].
В то же время в документах имеются некоторые различия. Так, в соответствии с НД FDA для того, чтобы ЛП был зарегистрирован по процедуре «биовейвер», он должен: содержать ФС только I класса; быть «быстрорастворимым», не абсорбироваться в ротовой полости [36, 48, 117].
Требования ВОЗ шире, чем требования FDA, и допускают регистрацию ЛП, содержащих не только ФС I, но и других классов по БКС [24, 114, 116]. Если ЛП содержит ФС I класса, он должен быть быстро- или очень быстрорастворимым, как и препарат сравнения. В то же время очень быстрое растворение не обязательно гарантирует биоэквивалентность их ЛП, авторы считают, что требование «быстрое растворение» и подобие профилей растворения являются достаточным критерием [118].
Если ЛП содержит ФС II класса, то субстанция должна обладать слабокислыми свойствами, иметь высокую растворимость только при значении рН 6,8; ЛП должен быть быстрорастворимым, а профиль его растворения — подобен профилю растворения препарата сравнения в трех средах.
В случае если ЛП содержит ФС III класса, то он должен быть очень быстрорастворимым; профиль его растворения должен быть подобен профилю растворения препарата сравнения в трех средах; соотношения риск – преимущества должны быть дополнительно подтверждены с точки зрения степени, места и механизма абсорбции [119].
Для ЛП с ФС IV класса необходимо определять биоэквивалентность толькоin vivo [23].
Процедура «биовейвер» предназначается только для определения биоэквивалентности и не заменяет оценку биодоступности или другие фармакокинетические исследования [120].
В 2010 г. EMA утвердило документ, регламентирующий проведение процедуры «биовейвер» и допускающий ее для ЛП с ФС I и III класса БКС [22, 121]. Среды растворения аналогичны указанным в документе ВОЗ. Составы буферов должны соответствовать Европейской Фармакопее. Дополнительно можно проводить исследования при значении рН, при котором субстанция имеет минимальную растворимость. Должна быть подтверждена неизменность гранулометрического состава и полиморфного состояния субстанций исследуемого ЛП и препарата сравнения [117].
Документы по процедуре «биовейвер» в Японии предназначены для дженериков. Основное их отличие в том, что БКС не признается, т. к. считается, что причинами бионеэквивалентности пероральных ЛП являются не проницаемость и растворимость ФС, а различия в ЛФ и/или производственных процессах [115, 116]. Процедура «биовейвер» может применяться для ФС любого класса, разрешена для ЛП с модифицированным высвобождением [117].
В 2007 г. На Украине был утвержден НД, разработанный в соответствии с рекомендациями ВОЗ и допускающий упрощенную регистрацию дженериков без проведения исследований биоэквивалентности [21]. По процедуре «биовейвер» на Украине зарегистрировано 8 ЛП.
В Швеции одобрена процедура «биовейвер» для ЛП, содержащих ибупрофен, парацетамол, преднизолон [122].
В Канаде опубликован для обсуждения проект документа по процедуре «биовейвер», допускающий ее для ЛП, содержащих ФС I и III классов [123].
В России в настоящее время процедура «биовейвер» законодательно не регламентируется, испытания сравнительной кинетики растворения in vitro применяются для оценки эквивалентности разных дозировок одного и того же дженерика [29]. Однако подготовлены методические рекомендации, регламентирующие проведение процедуры, проводится работа по их внедрению [124].
Использованию БКС и процедуры «биовейвер» в настоящее время препятствует отсутствие перечня с однозначным распределением ФС по классам БКС [38].
В то же время ограничение дорогостоящих испытаний in vivo делает вопрос широкого применения БКС на отечественном фармацевтическом рынке чрезвычайно актуальным. Оценка биоэквивалентности методом in vitro вместо in vivoпозволит сэкономить от 22 до 38 млн долларов ежегодно [12].
Источник
База данных по классам БКС
Биофармацевтическая классификационная система (БКС) была разработана Gordon Amidon с соавторами в 1995 году. В основе БКС лежит классификация всех фармацевтических субстанций по водной растворимости (solubility) и кишечной проницаемости (permeability).
В соответствии с этими свойствами все лекарственные вещества разделяют на 4 класса:
- I — высокая растворимость, высокая проницаемость;
- II — низкая растворимость, высокая проницаемость;
- III — высокая растворимость, низкая проницаемость;
- IV — низкая растворимость, низкая проницаемость.
В данном разделе приведена справочная информация по классам БКС для 360 лекарственных веществ, описанных в базе данных http://www.tsrlinc.net/search.cfm. В конце раздела на примере типовой таблицы результатов приведены наши комментарии и пояснения по алгоритму присвоения класса по БКС.
Обращаем внимание, что в приведенной базе данных (как и в большинстве других) оценка проницаемости может проводиться при помощи компьютерного моделирования на основе расчетных значений LogP или сLogP. Настоятельно рекомендуется использовать несколько информационных источников прежде, чем сделать вывод о принадлежности конкретной субстанции к определенному классу по БКС.
| Английское название | Русское название | Класс по БКС |
|---|---|---|
| Abacavir | Абакавир | I или III |
| Acarbose | Акарбоза | III |
| Aceclofenac | Ацеклофенак | II |
| Acetaminophen (Paracetamol) | Ацетаминофен (Парацетамол) | IV |
| Acetazolamide | Ацетозоламид | IV |
| Acetylcarnitine | Ацетилкарнитин | III и N/A |
| Acetylsalicylic acid | Ацетилсалициловая кислота | IV |
| Acyclovir | Ацикловир | III или IV |
| Albendazole | Альбендазол | II |
| Albuterol (Salbutamol) | Альбутерол (Сальбутамол) | III |
| Alendronic acid | Алендроновая кислота | III |
| Alfacalcidol | Альфакальцидол | I |
| Alibendol | Алибендол | I или III |
| Allopurinol | Аллопуринол | IV |
| Alprazolam | Альпразолам | I |
| Aluminium hydroxide | Алюминия гидроксид | N/A или IV |
| Ambroxol | Амброксол | I |
| Amiloride | Амилорид | III |
| Amisulpride | Амисульприд | N/A |
| Amitriptyline | Амитриптилин | I |
| Amlodipine | Амлодипин | I |
| Amoxicillin | Амоксициллин | IV (Human) |
| Amphetamine (mixed salt) | Амфетамин (смешанная соль) | I или III |
| Anastrozole | Анастрозол | I |
| Aripiprazole | Арипипразол | N/A |
| Artemether | Артеметр | N/A |
| Ascorbic acid | Аскорбиновая кислота | III |
| Atenolol | Атенолол | III (Human) |
| Atomoxetine hydrochloride | Атомоксетина гидрохлорид | N/A |
| Atorvastatin | Аторвастатин | II |
| Atropine | Атропин | III |
| Azathioprine | Азатиоприн | IV |
| Azelastine | Азеластин | I |
| Azithromycin | Азитромицин | II |
| Azulene | Азулен | I |
| Benazepril | Беназеприл | I |
| Benidipine | Бенидипин | II или N/A |
| Benserazide | Бенсеразид | III |
| Benznidazole | Бензнидазол | III или N/A |
| Beraprost | Берапрост | I |
| Bicalutamide | Бикалутамид | II |
| Biperiden | Бипериден | I |
| Bisacodyl | Бисакодил | II |
| Bisoprolol | Бисопролол | I или III |
| Brompheniramine | Бромфенирамин | N/A или I |
| Brotizolam | Бротизолам | I |
| Bupropion | Бупропион | I |
| Buspirone | Буспирон | I |
| Cabergoline | Каберголин | I или II |
| Camostat | Камостат | I или III |
| Candesartan cilexetil | Кандесартана цилексетил | II |
| Capecitabin | Капецитабин | III |
| Captopril | Каптоприл | III |
| Carbamazepine | Карбамазепин | II |
| Carbinoxamine | Карбиноксамин | N/A или I |
| Carvedilol | Карведилол | II |
| Cefaclor | Цефаклор | III |
| Cefcapene | Цефкапен | III или I |
| Cefdinir | Цефдинир | IV |
| Cefditoren | Цефдиторен | IV или II |
| Cefixime | Цефиксим | IV |
| Cefmetazole | Цефметазол | III |
| Cefotiam | Цефотиам (цефотаксим) | IV |
| Cefpodoxime | Цефподоксим | IV |
| Cefprozil | Цефпрозил | N/A |
| Cefroxadine | Цефроксадин (Цефуроксим) | III |
| Cefuroxime axetil | Цефуроксима аксетил | IV |
| Celecoxib | Целекоксиб | II |
| Cetirizine | Цетиризин | II |
| Chloramphenicol | Хлорамфеникол | III |
| Chloroquine | Хлорохин | II |
| Chlorpheniramine | Хлорфенирамин | I |
| Chlorpromazine | Хлорпромазин | II |
| Choline Alfoscerate | Холина Альфосцерат | III или N/A |
| Cilazapril | Цилазаприл | III |
| Cilnidipine | Цилнидипин | N/A |
| Cilostazol | Цилостазол | II |
| Cimetidine | Циметидин | III |
| Cimetropium bromide | Циметропия бромид | N/A |
| Ciprofloxacin | Ципрофлоксацин | III |
| Citalopram (escitalopram) | Циталопрам (Эсциталопрам) | I |
| Clarithromycin | Кларитромицин | II |
| Clofazimine | Клофазимин | II |
| Clomiphene | Кломифен | I |
| Clomipramine | Кломипрамин | I |
| Clonidine | Клонидин | III |
| Clopidogrel | Клопидрогель | II |
| Cloxacillin | Клоксациллин; | I |
| Clozapine | Клозапин | II |
| Codeine | Кодеин | III |
| Colchicine | Колхицин | III |
| Cyclophosphamide | Циклофосфамид | III |
| Cyclosporine | Циклоспорин | II |
| Cyproterone | Ципротерон | II |
| Dapsone | Дапсон | IV |
| Desloratadine | Дезлоратодин | I |
| Desogestrel | Дезогестрел | N/A |
| Dexamethasone | Дексаметазон | II или IV |
| Diacerein | Диацереин | N/A |
| Diazepam | Диазепам | II |
| Diclofenac | Диклофенак | II |
| Didanosine | Диданозин | III |
| Diethylcarbamazine | Диэтилкарбамазин | I или III |
| Digoxin | Дигоксин | III |
| Diloxanide | Дилоксанид | II |
| Diltiazem | Дилтиазем | I |
| Dolasetron | Доласетрон | I |
| Domperidone | Домперидон | I |
| Donepezil | Донепезил | I |
| Doxazosin | Доксазозин | I |
| Doxifluridine | Доксифлуридин | III |
| Doxycycline | Доксициклин | IV |
| Ebastine | Эбастин | II |
| Efavirenz | Эфавиренз | II |
| Enalapril | Эналаприл | I |
| Epalrestat | Эпалрестат | II |
| Eperisone | Эперизон | I |
| Epinastine | Эпинастин | I |
| Eprosartan | Эпросартан | II |
| Erdosteine | Эрдостеин | N/A |
| Ergocalciferol | Эрогокальциферол | I |
| Ergonovine | Эргоновин (Эргометрин) | III |
| Ergotamine | Эроготамин | I |
| Erythromycin | Эритромицин | II |
| Ethambutol | Этамбутол | III |
| Ethinyl estradiol | Этинилэстрадиол | I |
| Ethosuximide | Этосуксимид | III |
| Ethyl icosapentate | Этиликозапентат | II |
| Etizolam | Этизолам | I |
| Ezetimibe | Эзетимиб | II |
| Famciclovir | Фамцикловир | III |
| Famotidine | Фамотидин | IV |
| Fenofibrate | Фенофибрат | II |
| Ferrous sulfate | Железа сульфат | N/A |
| Fexofenadine | Фексофенадин | I |
| Finasteride | Финастерид | I |
| Fluconazole | Флуконазол | III |
| Fluoxetine | Флуоксетин | I |
| Flurbiprofen | Флурбипрофен | II |
| Fluvastatin | Флувастатин | I |
| Fluvoxamine | Флувоксамин | I |
| Folic acid | Фолиевая кислота | IV |
| Furosemide | Фуросемид | IV |
| Fursultiamine | Фурсултиамин | III |
| Gabapentin | Габапентин | III |
| Gefitinib | Гефитиниб | II |
| Gemifloxacin | Гемифлоксацин | N/A |
| Gliclazide | Гликлазид | IV или II |
| Glimepiride | Глимепирид | II |
| Glipizide | Глипизид | II |
| Glyburide (glibenclamide) | Глибурид (глибенкламид) | II |
| Granisetron | Гранисетрон | I |
| Griseofulvin | Гризеофульвин | II |
| Haloperidol | Галоперидол | II |
| Hydralazine | Гидралазин | III |
| Hydrochlorothiazide | Гидрохлоротиазид | IV |
| Hydroxyzine | Гидроксизин | II |
| Ibuprofen | Ибупрофен | II |
| Imatinib | Иматиниб | II |
| Imidapril | Имидаприл | I или III |
| Indapamide | Индапамид | I |
| Indinavir | Индинавир | II |
| Iopanoic acid | Иопановая кислота | II или N/A |
| Irbesartan | Ирбесартан | II |
| Isoniazid | Изониазид | III |
| Isosorbide dinitrate | Изосорбида динитрат | III |
| Isotretinoin | Изотретиноин | II |
| Itopride | Итоприд | N/A |
| Itraconazole | Итраконазол | II |
| Ivermectin | Ивермектин | II или N/A |
| Ketoprofen | Кетопрофен | II |
| Ketotifen | Кетотифен | I |
| Lamivudine | Ламивудин | III |
| Lamotrigine | Ламотриджин | II |
| L-carbocysteine | л-Карбоцистеин | IV |
| Lercanidipine | Лерканидипин | N/A |
| Letrozole | Летрозол | I |
| Levamisole | Левамизол | I или III |
| Levetiracetam | Леветирацетам | III |
| Levodopa | Леводопа | I или II |
| Levofloxacin | Левофлоксацин | III или I |
| Levonorgestrel | Левоноргестрел | I |
| Levothyroxine | Левотироксин | I |
| Limaprost | Лимапрост | I |
| Linezolid | Линезолид | IV |
| Lisinopril | Лизиноприл | III |
| Lithium carbonate | Лития карбонат | N/A |
| Lopinavir | Лопинавир | II |
| Desloratadine | Дезлоратодин | I |
| Lorazepam | Лоразепам | II или I |
| Losartan | Лозартан | III |
| Lovastatin | Ловастатин | II |
| Loxoprofen | Локсопрофен | I |
| Lumefantrine | Люмефантрин | I |
| Manidipine | Манидипин | II или N/A |
| Mebendazole | Мебендазол | II |
| Mecobalamin | Мекобаламин | III или N/A |
| Medroxyprogesterone | Медроксипрогестерон | II |
| Mefloquine | Мефлохин | I |
| Meloxicam | Мелоксикам | II |
| Menatetrenone | Менатетренон | II |
| Mesalamine | Мезаламин (Месалазин) | IV |
| Metaxalone | Метаксалон | II |
| Metformin | Метформин | III |
| Methionine | Метионин | III |
| Methotrexate | Метотрексат | III |
| Methyldopa | Метилдопа | III |
| Methylphenidate | Метилфенидат | II или IV |
| Metoclopramide | Метоклопрамид | II |
| Metoprolol | Метопролол | I |
| Metronidazole | Метронидазол | IV |
| Mexiletine | Мексилетин | I |
| Mirtazapine | Миртазапин | I |
| Modafinil | Модафинил | IV |
| Montelukast | Монтелукаст | I |
| Morphine | Морфин | III |
| Mosapride | Мозаприд | II |
| Moxifloxacin | Моксифлоксацин | N/A |
| Mycophenolate mofetil | Микофенолата мофетил | II |
| Nabumetone | Набуметон | II |
| Nalidixic acid | Налидиксовая кислота | IV |
| Nelfinavir | Нелфинавир | II |
| Neostigmine | Неостигмин | III или I |
| Nevirapine | Невирапин | II |
| Niacin | Ниацин | III |
| Nicardipine | Никардипин | I |
| Nicergoline | Ницерголина | II |
| Niclosamide | Никлозамид | II |
| Nicorandil | Никорандил | III или N/A |
| Nicotinamide | Никотинамид | III |
| Nifedipine | Нифедипин | II |
| Nifurtimox | Нифуртимокс | III или N/A |
| Nilvadipine | Нильвадипин | II или N/A |
| Nimesulide | Нимесулид | II |
| Nitrofurantoin | Нитрофурантоин | IV |
| Nitroglycerin | Нитроглицерин | I или III |
| Nizatidine | Низатидин | III |
| Norethindrone | Норэтиндрон (Норэтистерон) | I |
| Norgestimate | Норгестимат | I |
| Nystatin | Нистатин | IV |
| Olanzapine | Оланзапин | II |
| Olopatadine | Олопатадин | III или I |
| Ondansetron | Ондансетрон | I |
| Orlistat | Орлистат | II |
| Oseltamivir | Осельтамивир | I или III |
| Oxcarbazepine | Окскарбазепин | IV |
| Oxiracetam | Оксирацетам | N/A |
| Oxybutynin | Оксибутинин | I |
| Oxycodone | Оксикодон | IV |
| Pamidronate | Памидронат | III |
| Paroxetine | Пароксетин | I |
| Penicillamine | Пеницилламин | III |
| Pergolide | Перголид | I |
| Perindopril | Периндоприл | III или I |
| Phendimetrazine | Фендиметразин | I или III |
| Phenobarbital | Фенобарбитал | IV |
| Phenoxymethylpenicillin | Феноксиметилпенициллин | I |
| Phenytoin | Фенитоин | II |
| Pilsicainide | Пилсикаинид | I |
| Pinaverium bromide | Пинаверия бромид | N/A |
| Pioglitazone | Пиоглитазон | II |
| Pranlukast | Пранлукаст | II |
| Pravastatin | Правастатин | I или III |
| Praziquantel | Празиквантел | II |
| Prednisolone | Преднизолон | III |
| Primaquine | Примахин | I |
| Procaterol | Прокатерол | III |
| Proguanil | Прогуанил | I |
| Promethazine | Прометазин | I |
| Propiverine | Пропиверин | I |
| Propranolol | Пропранолол | I (Human) |
| Propylthiouracil | Пропилтиоурацил | IV |
| Pseudoephedrine | Псевдоэфедрин | III |
| Pyrantel | Пирантел | II |
| Pyrazinamide | Пиразинамид | III |
| Pyridostigmine bromide | Пиридостигмина бромид | III |
| Pyridoxine hydrochloride | Пиридоксина гидрохлорид | III |
| Pyrimethamine | Пириметамин | II |
| Quetiapine | Кветиапин | I или II |
| Quinapril | Хинаприл | I |
| Quinine | Хинин | II |
| Rabeprazole | Рабепразол | I или III |
| Raloxifene | Ралоксифен | II |
| Ramipril | Рамиприл | I |
| Ranitidine | Ранитидин | III |
| Rebamipide | Ребамипид | II |
| Reserpine | Резерпин | I |
| Retinol | Ретинол | II |
| Ribavirin | Рибавирин | III |
| Riboflavin | Рибофлавин | III |
| Rifampicin | Рифампицин | II |
| Risedronic acid | Ризедроновая кислота | III |
| Risperidone | Рисперидон | II |
| Ritonavir | Ритонавир | II |
| Rivastigmine | Ривастигмин | I |
| Rizatriptan | Ризатриптан | III |
| Rofecoxib | Рофекоксиб | II |
| Rosiglitazone | Росиглитазон | I |
| Roxatidine acetate | Роксатидина ацетат | N/A |
| Roxithromycin | Рокситромицин | II или N/A |
| Saquinavir | Саквинавир | I |
| Sarpogrelate hydrochloride | Сапрогрелат гидрохлорид | I |
| Sennoside A | Сеннозид А | N/A |
| Sertraline | Сертралин | I |
| Sildenafil | Силденафил | I |
| Simvastatin | Симвастатин | II |
| s-Methylmethionine | S-метилметионин | III или N/A |
| Sodium Iodide | Натрия йодид | III или N/A |
| Spironolactone | Спиронолактон | II |
| Stavudine | Ставудин | III |
| Sulfadiazine | Сульфадиазин | IV |
| Sulfamethoxazole | Сульфаметоксазол | IV |
| Sulfasalazine | Сульфасалазин | II |
| Sulpiride | Сульпирид | IV |
| Sultamicillin | Сультамициллин | II или IV |
| Sumatriptan | Суматриптан | III |
| Tacrolimus | Такролимус | I или II |
| Talniflumate | Талнифлюмат | N/A |
| Taltirelin | Талтирелин | III |
| Tamoxifen | Тамоксифен | II |
| Tamsulosin | Тамсулозин | I |
| Tegafur | Тегафур | III |
| Telmisartan | Телмисартан | II |
| Temocapril | Темокаприл | I |
| Tenofovir | Тенофовир | III |
| Teprenone | Терпенон | II |
| Terazosin | Теразозин | I или III |
| Terbinafine | Тербинафин | I |
| Theophylline | Теофиллин | IV |
| Thiamine | Тиамин | III или N/A |
| Thioctic Acid | Тиоктовая кислота | I |
| Tibolone | Тиболон | N/A |
| Ticlopidine | Тиклопидин | II |
| Tiropramide | Тиропрамид | N/A |
| Tocopherol nicotinate | Токоферола никотинат | II |
| Tolterodine | Толтеродин | I |
| Topiramate | Топирамат | III |
| Toremifene | Торемифен | I |
| Tosufloxacin | Тосуфлоксацин | IV или II |
| Tramadol | Трамадол | I |
| Triclabendazole | Триклабендазол | N/A |
| Triflusal | Трифлусал | II |
| Trimebutine | Тримебутин | I |
| Trimetazidine | Триметазидин | III |
| Trimethoprim | Триметоприм | IV |
| Tulobuterol | Тулобутерол | I |
| Ursodeoxycholic Acid | Урсодезоксихолевая кислота | II |
| Valacyclovir | Валацикловир | I |
| Valdecoxib | Вальдекоксиб | N/A |
| Valproic acid | Вальпроевая кислота | II |
| Valsartan | Валсартан | II |
| Venlafaxine | Венлафаксин | I |
| Verapamil | Верапамил | II (Human) |
| Voglibose | Воглибоза | III |
| Warfarin | Варфарин | II |
| Zaltoprofen | Залтопрофен | II |
| Zidovudine | Зидовудин | III |
| Ziprasidone | Зипрасидон | N/A |
| Zolmitriptan | Золмитриптан | III |
| Zolpidem | Золпидем | I или III |
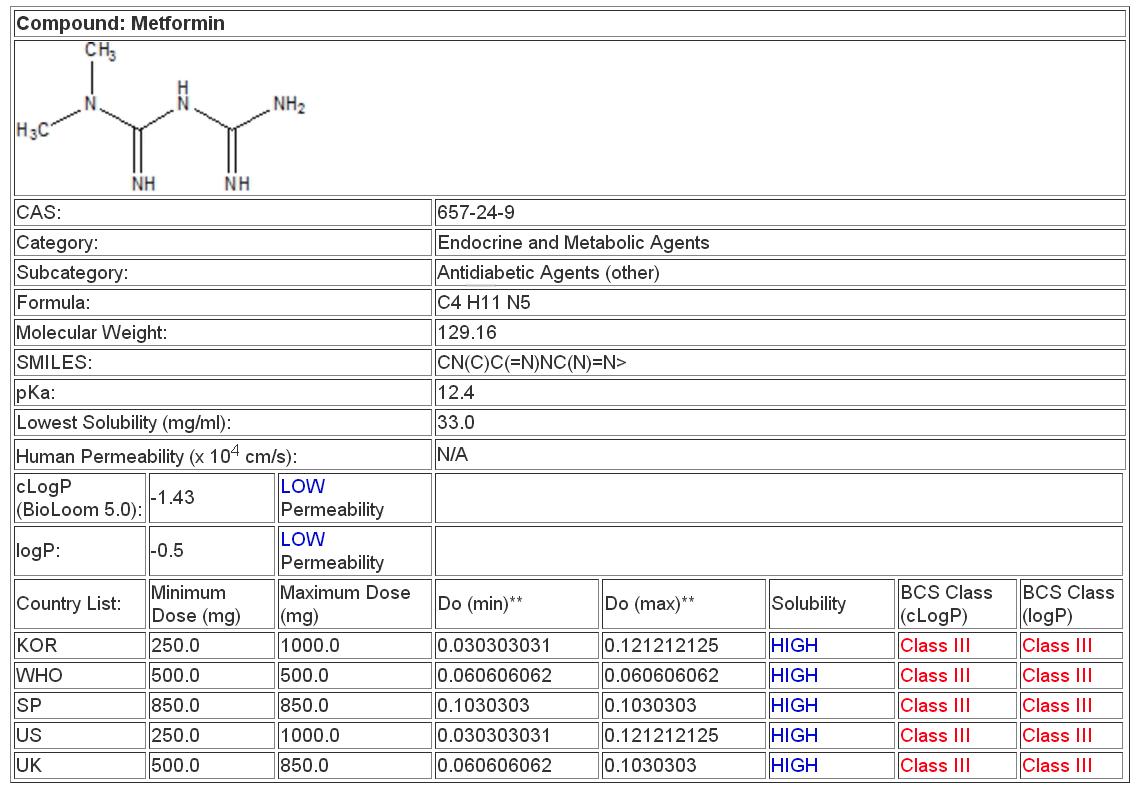
Пример таблицы результатов с комментариями и пояснениями:
Ниже приведены пояснения к отдельным строкам таблицы результатов:
- Lowest Solubility (mg/ml) — минимальная растворимость субстанции в диапазоне pH от 1,2 до 6,8, определенная при температуре 37 °С
- Human Permeability (x 10^4 cm/s) — данные по проницаемости, полученные в исследованиях на человеке. Доступны для крайне ограниченного числа лекарственных средств. При наличии таких данных коэффициенты LogP и сLogP не используют.
- LogP — десятичный логарифм коэффициента распределения в системе 1-октанол-вода (коэффициент липофильности).
- cLogP (BioLoom 5.0) — LogP, рассчитанный при помощи программы BioLoom 5.0.
- Country List, Minimum Dose (mg), Maximum Dose (mg) — минимальная и максимальная дозировки лекарственного препарата могут различаться в зависимости от страны.
- Do (min) и Do (max) — вычисляют по формуле: дозировка/(250 мл х мин. растворимость).
В Японии используют объем 150 мл. - Solubility (High или Low) — растворимость считается низкой при Do (max) > 1.
- BCS Class (cLogP) — при определении класса по БКС использовалось значение cLogP.
- BCS Class (LogP) — при определении класса по БКС использовалось значение LogP.
- В настоящей базе данных за эталонное вещество при оценке проницаемости был выбран метопролол (известно, что степень его абсорбции из ЖКТ составляет 95 %). Для метопролола cLogP = 1,49, а LogP = 1,88.
- Принято, что если значение коэффициента липофильности (cLogP или LogP) выше чем у метопролола, то вещество проявляет высокую проницаемость.
- Соответственно может оказаться, что проницаемость через cLogP высокая, а через LogP низкая, несмотря на то, что cLogP меньше LogP.
Источник