- Баллонная ангиопластика: области применения и ход процедуры
- Определение:
- Области применения
- Как выполняется баллонная ангиопластика?
- Ангиопластика легочных артерий
- Кратко о методе лечения
- Преимущества лечения в ИСЦ
- Показания и противопоказания к методу лечения
- Подготовка к лечению
- Обезболивание при лечении
- Как проходит метод лечения
- Баллонная ангиопластика с лекарственным покрытием
Баллонная ангиопластика: области применения и ход процедуры
Определение:
Баллонная ангиопластика — эндоваскулярная операция, которая устраняет окклюзионно-стенотические процессы в пораженной артерии и возобновляет в ней кровоток. Такой метод считают одним из самых эффективных способов лечения ишемической болезни сердца (ИБС), предупреждения развития инсульта и инфаркта миокарда.
В 1977 году произошел переворот в эндоваскулярной хирургии, когда швейцарский кардиолог Андреас Грюнтциг провел первую операцию по коронарной ангиопластике, применив для этого баллонный катетер, сделанный им в домашних условиях. Эта процедура быстро распространилась во всем мире. Медики называют эту процедуру чрескожной транслюминарной баллонной ангиопластикой , что обозначает:
- Чрескожная — операция выполняется путем прокалывания кожи и катетеризации сосудов.
- Транслюминальная — не требует открытого хирургического вмешательства.
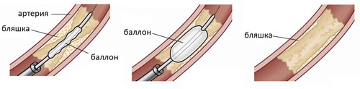
- Баллонная — сосудистый просвет восстанавливается при помощи раздувания баллона, размещённого на конце катетера.
- Ангиопластика — вмешательство направлено на восстановление сосуда.
Области применения
Баллонная ангиопластика сегодня широко применяется в кардиологии и сосудистой хирургии. Она стала более доступной и безболезненной альтернативой открытым вмешательствам. Показания к проведению баллонной ангиопластики — сужение коронарных, церебральных, почечных артерий, заболевания сосудов ног. Баллонная ангиопластика применяется и в экстренных случаях, например, на ранних стадиях инфаркта, позволяя остановить его развитие.
Баллонная ангиопластика чаще проводится совместно со стентированием. Чтобы восстановленный сосудистый просвет не сузился вновь, в его стенки устанавливают металлическую трубочку, которая берет на себя функции каркаса артерии. Ознакомьтесь с видеозаписью стентирования сосудов сердца тут.
Как выполняется баллонная ангиопластика?
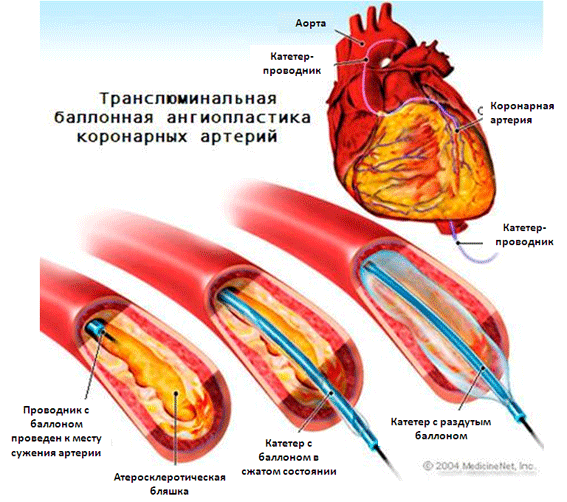
Процедура ангиопластики проходит в операционной, оборудованной рентгеновским аппаратом и техникой для записи. Перед вмешательством проводится обследование, которое включает ангиографическое исследование. В ряде случаев ангиопластика сосудов сердца проводится прямо в процессе выполнения коронарографии, если доктор видит для этого достаточные основания. Такая возможность заранее оговаривается на приеме кардиолога перед диагностикой.
Баллонная ангиопластика проходит в несколько этапов и длится от получаса до нескольких часов.
Место, через которое в артерию вводят интродьюсер, обезболивается. В зависимости от того, в каких сосудах проводится вмешательство, прокол делают в артерии ноги или руки.
Делается небольшой прокол, в который устанавливают сам интродьюсер. Через него в артерию вводят инструменты.
В артерию вводят контрастную жидкость. Проводится ангиография сосуда, с помощью которой доктор увидит и оценит зону стеноза или окклюзии.
Следующий этап — введение катетера с баллончиком. Когда он достигает пораженной зоны, баллончик раздувают, тем самым расширяя сосуд.
Проводят установку стента.
Катетер выводят из артерии.
На место введения инструментов накладывают тугую повязку, после чего пациента оставляют под интенсивным наблюдением в стационаре сосудистой клиники.
Уже через несколько дней пациент возвращается к обычной жизни. При выписке из больницы ему дают рекомендации, касающиеся приема медикаментов и образа жизни.
Источник
Ангиопластика легочных артерий
Кратко о методе лечения
Хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ), является результатом неполного рассасывания тромбов после тромбоэмболи легких. Тромбы превращаются в волокнистую ткань в ветвях легочных артерий, заполняя их просвет и создают препятствия кровотоку.
Методом выбора лечения является легочная эндартерэктомия — удаление рубцовых тканей из легочных артерий открытым способом. Однако подобная операция проводится в условиях искусственного кровообращения и имеет весьма серьезные риски, особенно для декомпенсированных пациентов.
Баллонная ангиопластика легочных артерий является новым методом лечения и имеет большие перспективы для успешного лечения пациентов, не подлежащих открытой операции. Результаты современных исследований показывают что ангиопластика легочных артерий улучшает функциональное состояние сердца и легких у больных с ХТЭЛГ и улучшает качество и продолжительность их жизни. Осложнения включают кровохарканье, травму легочных сосудов, реперфузионный отек легких, легочные паренхиматозные кровотечения и геморрагический плевральный выпот. Летальность при подобном методе лечения составляет менее 3%, против 8% при открытых операциях.
Преимущества лечения в ИСЦ
Наша клиника является одним из немногих в России медицинских учреждений, где взялись за лечение таких тяжелых пациентов, как больные с тромбоэмболической легочной гипертензией.
Основой успеха подобных вмешательств является тщательное предоперационное обследование и подготовка. В нашей клинике проводятся все необходимые обследования, включая мультиспиральную компьютерную ангиографию легочных артерий и измерение давления в полостях сердца и легочной артерии.
Ангиопластику мы проводим с анестезиологической и реанимационной поддержкой, позволяющей купировать возможные осложнения в самые кратчайшие сроки. Применение подобного подхода позволяет добиваться лучших результатов лечения у данной категории пациентов.
Показания и противопоказания к методу лечения
- Хроническая легочная гипертензия II-IV функционального класса, связанная с тромбоэмболией.
- Пациенты не подходят для операции в условиях искусственного кровообращения из за высокого риска.
- Рецидив легочной гипертензии после проведенного хирургического лечения.
- Больные с поражением долевых и сегментарных отделов легочных артерий
- Отсутствует недостаточность кровообращения, связанная с левыми отделами сердца
Подготовка к лечению
- Детальная диагностика состояния легочных артерий и функции сердца.
- Компенсация недостаточности кровообращения.
- Купирование обострений хронических легочных заболеваний.
- Перед операцией устанавливается мочевой и центральный венозный катетер.
- Накануне операции легкий ужин, утром завтракать нельзя.
Обезболивание при лечении
Вмешательство проводится без разрезов поэтому для обезболивания доступа достаточно местной анестезии.
Как проходит метод лечения
Операция состоит из оценки поражений легочной артерии во время выполнения ангиопульмонографии и коррекцию выявленных поражений с помощью баллонной ангиопластики.
Чрескожный доступ осуществляется через бедренную или яремную вену. В легочную артерию проводится проводник и специальный длинный катетер. Для профилактики тромботических осложнений вводится 2000 единицы гепарина в час. Пациенту дают кислородную маску, чтобы поддерживать высокий уровень насыщения крови кислородом.
Катетер поочередно устанавливается в правую и левую легочные артерии для выполнения ангиографии. Основной целью для баллонной ангиопластики является правая нижнедолевая артерия. Чтобы провести туда катетер, пациенту приходится задерживать дыхание на 20 секунд. Поражения легочных артерий могут представлять собой волокнистые спайки, закупорки, мембраны. Проводник осторожно проводится через зону препятствия, после чего необходимо измерить давление до и после препятствия. Следующим этапом проводится баллон небольшого диаметра, который раздувается на малом давлении, до полного распрямления. Затем устанавливают и раздувают баллон большего диаметра. Максимальное давление — 5-6 атмосфер. Для профилактики отека легких за одну процедуру выполняют восстановление проходимости одной артерии. Через 1-2 месяца можно выполнить повторение процедуры в другом сегменте.
Источник
Баллонная ангиопластика с лекарственным покрытием
Хирургические методы лечения ИБС имеют своей целью прямое увеличение коронарного кровотока – реваскуляризацию миокарда.
Транслюминальная баллонная ангиопластика (ТЛБАП) – операция, позволяющая восстановить кровоток в артериях сердца (коронарных артериях) путём проведения катетера с баллоном и последующем его раздуванием. Операция ТЛБАП сопровождалась высоким риском осложнений в виде повторного сужения сосуда – рестеноза, острых окклюзий. В современной эндоваскулярной хирургии ТЛБАП выполняется вместе с эндопротезированием венечных (коронарных) артерий, т.е. имплантацией стентов в коронарное русло.
Положительные результаты рандомизированных исследований сделало стентирования коронарных артерий ведущим стандартом в лечении больных ИБС. С 1999 году под термином чрескожное коронарное вмешательство «по умолчанию» подразумевать именно стентирование коронарных артерий.
Стентирование коронарных артерий или чрескожное коронарное вмешательство – операция, позволяющая восстановить кровоток в артериях сердца (коронарных артериях) путём имплантации стентов в месте сужения коронарной артерии.
Сегодня коронарное стентирование занимает ведущее место в эндоваскулярном лечении больных ИБС. Внедрение этого метода позволило значительно улучшить результаты традиционной ТЛБАП – как непосредственные, так и отдаленные. Основным недостатком стентирования (как и баллонной ангиопластики) является относительно высокая частота рестенозирования. Если применение эндопротезов кардинально решило проблему таких острых осложнений ТЛБАП, как диссекции и острые окклюзии, сведя к минимуму летальность и прочие ишемические осложнения (соответственно, и необходимость выполнения экстренной АКШ), а применение нового режима вспомогательной фармакотерапии (аспирин, клопидогрель, ингибиторы IIb/IIIa-рецепторов), с одной стороны, практически свело к нулю частоту развития подострого тромбоза стентов (и связанных с этим ишемических осложнений), а с другой – позволило имплантировать эндопротезы при остром коронарном синдроме, то в плане отдаленных результатов не произошло революционного сдвига.
Несмотря на то, что отдаленные результаты после стентирования и превосходят результаты ТЛБАП (частота рестенозирования в различных клинических ситуациях в среднем в 1,5–2,5 раза ниже, чем после баллонной дилатации), все же самым серьезным недостатком эндопротезирования (как и всех эндоваскулярных методик) остается относительно высокая частота возврата стенокардии в отдаленном периоде и, соответственно, частая необходимость повторной реваскуляризации миокарда.
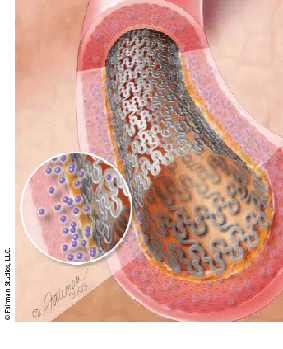
Стент – внутрисосудистый протез для поддержания стенки пораженного сосуда и сохранения диаметра его просвета. Конструкция стента представляет собой тонкий сетчатый каркас из инертного металлического сплава высочайшего качества, раскрываемый баллоном внутри сосуда до нужного диаметра.
Виды стентов:
Металлический стент (Bare Metal Stent) – внутрисосудистый протез из нержавеющей стали или кобальт-хромового сплава. Использование металлических стентов связано с риском тромбоза в первые 30 дней и требует двойной антитромбоцитарной терапии в течении 1 месяца, а также 20-30% риском рестеноза (повторного сужения сосуда) в течение 6-9 месяцев после имплантации.
Стент с лекарственным покрытием — внутрисосудистый протез с покрытием (полимером), высвобождающим лекарственное вещество
Первое поколение стентов с лекарственным покрытием: сиролимус- и паклитаксел-покрытые стенты. Множественные рандомизированные исследования показали, что сиролимус- и паклитаксел-покрытые стенты ассоциируются со снижением частоты повторной реваскуляризации и смерти от инфаркта миокарда по сравнению с металлическими стентами. В состав покрытия стентов первого поколения входили полимеры, которые облегчали высвобождение лекарственных компонентов, но оставались на стенте после растворения медикаментозного слоя. Эти постоянные полимеры могут вызывать воспаление и задержку эндотелизации, что требует длительной двойной антиагрегантной терапии с целью предупреждения высокого уровня поздних и очень поздних тромбозов стентов.
За последнее время использование стентов с лекарственным покрытием показало явное их преимущество в борьбе с рестенозом. В клинической практике при использовании стентов без покрытия частота рестеноза в отдаленном периоде оставалась на относительно высоком уровне, начали рассматривать полимерные покрытия как транспортное средство для местной доставки препарата. Целью этого является дозированное выделение необходимого лекарственного средства из устойчивого покрытия в локальную зону поражения сосудистой стенки. Выделение препарата происходит в равномерно дозированной концентрации в определенном временном интервале. Система доставки препарата не теряет своих свойств при стерилизации, так же изменяет свою геометрическую и объемную форму вслед за стентом при его имплантации и устойчива к механическим повреждениям вследствие раздувания баллона. Все вышеизложенные свойства системы локальной доставки препарата осуществляются с помощью разнообразных полимерных структур, обеспечивающих целостность данной структуры при клиническом применении.
Лекарственный препарат должен обладать способностью ингибировать наибольшее количество различных компонентов комплексного процесса рестенозирования. Безудержный рост неоинтимы по некоторым основным характеристикам схож с ростом опухоли, что навело на мысль использования цитостатических препаратов Rapamycin (Sirolimus) и Paclitaxel (Taxol). Результаты превзошли все ожидания.
Второе поколение стентов с лекарственным покрытием: зотаролимус- и эверолимус- покрытые стенты. Стенты изготовлены из более тонкого кобальт-хромового сплава (балки стента – 0,091 мм, по сравнению со стентами первого поколения, где этот показатель составлял – 0,132 мм), демонстрируют превосходную прочность и радиоконтрастность, гибкость что способствует снижению частоты рестеноза. Лекарственный компонент покрытия из более биосовместимых полимеров наносится на всю поверхность стента, примерно 95% от общего количества зотаролимуса высвобождается в течение первых 15 дней после установки стента, эверолимуса – 80% в течение 30дней, последующие 20% за 4 месяца, что позволяет уменьшить воспаление сосудистой стенки. Клинические результаты в сравнении со стентами первого поколения показали эффективность и безопасность.
Стенты третьего поколения – бесполимерные биостенты на основе поли-L лактида или магния созданы с использованием частично и даже полностью биорастворимых полимеров. Биорассасывающиеся магниево-полимерные стенты полностью исчезают после того, как необходимая доза лекарственного компонента высвободилась и лечение сосуда завершено. Высвобождение лекарственных веществ и поддержание стенки сосуда осуществляется только до тех пор, пока сосуду необходимо лечение. Стенты с покрытием, подвергающимся полному биорассасыванию снижают частоту тромбоза стентов по сравнению со стентами без и с лекарственным покрытием.
Возможные перспективы рентгеноэндоваскулярной хирургии ИБС – широкое внедрение в клиническую практику новых генераций стентов с новыми биоабсорбируемыми полимерными покрытиями. Тем не менее их начальному применению должны предшествовать длительные и всеобъемлющие исследования по изучению непосредственных, особенно отдаленных, результатов после их использования.
Таким образом, на сегодняшний день нет альтернативы применению стентов с лекарственным антипролиферативным покрытием в лечении пациентов с ИБС. Широко дискутируемые данные о возможных поздних осложнениях (поздний тромбоз) ни в коей мере не могут являться основанием к прекращению их использования, а лишь дополнительно подчеркивают важность правильного определения показаний к стентированию, тщательного соблюдения всех технических аспектов процедуры имплантации, досконального соблюдения режима двухкомпонентной дезагрегантной терапии в отдаленном периоде.
Непрерывное улучшение конструкции стентов, приводящее к внедрению новых технических методик имплантации, таких как использование высокого давления, методика прямого стентирования (возможного благодаря уменьшению профиля стентов и закреплению его на баллонный катетер доставляющей системы); внедрение таких дополнительных методов визуализации, как интракоронарное ультразвуковое исследование (позволяющих оптимизировать окончательный результат эндопротезирования с высокой степенью точности); тщательный отбор пациентов для проведения процедуры (в зависимости от прогнозируемых непосредственных и отдаленных результатов), основанный на накопленном к настоящему времени колоссальном опыте, – все это позволяет надеяться на улучшение результатов как непосредственно данного метода, так и в целом результатов лечения больных ИБС.
Таким образом, высока вероятность того, что уже в ближайшем будущем изменятся как результаты эндоваскулярного лечения больных ИБС, так и концепция выбора метода реваскуляризации миокарда, подходы к лечению этого заболевания в целом. Применение стентов с лекарственным антипролиферативным покрытием является высокоэффективным методом лечения пациентов с различными клиническими формами ИБС и разными морфологически неблагоприятными вариантами поражения коронарного русла. Применение стентов с антипролиферативным покрытием, несмотря на увеличение объема и комплексности выполняемых вмешательств, позволяет добиться значительного снижения частоты рестенозирования в отдаленном периоде наблюдения – основного фактора, ограничивающего эффективность рентгеноэндоваскулярного лечения.
Источник