Диагностические и лечебно-профилактические бактериофаги
Применяемые на практике препараты бактериофагов представляют собой фильтрат бульонной культуры соответствующих микробов, лизированных фагом, содержащий живые частицы фага, а также растворённые антигены бактерий, освободившиеся из бактериальных клеток при их лизисе. Полученный препарат — жидкий бактериофаг должен иметь вид совершенно прозрачной жидкости жёлтого цвета большей или меньшей интенсивности.
активность, т.е. вирулентность.
Для применения с лечебно-профилактическими целями фаги могут выпускаться в форме таблеток с кислотоустойчивой оболочкой. Таблетированный сухой фаг более стабилен при хранении и удобен при применении. Одна таблетка сухого бактериофага соответствует 20-25 мл жидкого препарата. Срок годности сухого и жидкого препарата — 1 год. Жидкий бактериофаг следует хранить при температуре + 2 +10 С, сухой- не выше +1°С, но его можно хранить в холодильнике и при отрицательной температуре.
Принятый внутрь бактериофаг сохраняется в организме в течение 5-7 дней. Как правило, прием бактериофага не сопровождается какими-либо реакциями или осложнениями. Противопоказаний к приёму нет. Применяются в виде орошений, полосканий, примочек, тампонов, инъекций, а также вводят в полости — брюшную, плевральную, суставную и в мочевой пузырь.
Фаги могут применяться в качестве диагностических препаратов для установления рода и вида бактерий, выделенных в ходе бактериологического исследования (эпидемиологическое маркирование). Диагностические фаги выпускаются как в жидкой, так и сухой форме в ампулах. На ампулах указан титр, ДРТ (доза рабочего титра) или тип. Перед началом работы сухой бактериофаг разводится. Применяют в реакции фаголизабельности (метод Отто) или фаготипирования.
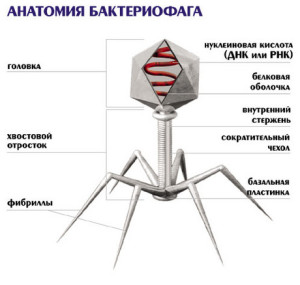
Схема описания бактериофагов:
Классификационное положение: бактериофаг
Действующее начало: бактериофаг
Получение: фильтрат фаголизата бульонной культуры соответствующего
Применение: лечебно-профилактические – для лечения и профилактики
диагностические – для идентификации микроорганизмов
Действие бактериофага на микробную культуру в жидкой среде и на плотной среде
Лизирующее действие бактериофага выражается в полном
просветлении бульонной культуры или в образовании на засеянных плотных средах пустых прозрачных участков среди густого налёта культуры на поверхности среды (стерильные пятна)
Метод Отто (стекающая капля)
Делают густой посев газоном исследуемой культуры. Через 5-10 мин после посева на подсушенную поверхность питательной среды наносят жидкий диагностический фаг. Чашку слегка наклоняют, чтобы капля фага растеклась по поверхности агара. Чашку помещают в термостат на 18-24 часа. Учёт опыта производят по полному отсутствию роста культуры в месте нанесения капли фага.
Опыт на жидкой питательной среде.
Делают посев исследуемой культуры в две пробирки с жидкой средой. В одну пробирку («О») добавляют петлёй диагностический бактериофаг. Через 18-20 часов в пробирке, куда бактериофаг не добавлялся («К»), наблюдается сильное помутнение бульона — произошел рост посеянной культуры. Бульон в пробирке, куда был добавлен бактериофаг, остался прозрачным вследствие лизиса культуры под его влиянием.
Метод титрования фага
Титрование фагов проводится на культурах бактерий в жидких и плотных средах с целью определения их активности.
Данный метод основан на внесении одной и той же дозь’1 культуры гомологичных микробов в различные концентрации титруемого бактериофага в мясо — пептонном бульоне.
Готовят десятикратные разведения исследуемого бактериофага в МПБ. Для этого в ряд пробирок разливают по 4,5 мл МПБ. В 1-ю пробирку добавляют 0,5 мл исследуемого фага. Тщательно перемешивают и переносят в последующие пробирки (из пробирки в пробирку) по 0,5 мл соответствующего разведения фага с уменьшением его концентрации в десять раз.
Получают разведения 10 -1 степени и т.д. до 10 -9 степени. После этого в пробирки вносят по 1 капле суточной культуры соответствующих бактерий. За титр бактериофага принимают то его максимальное разведение, при котором наблюдается полный лизис культуры.
Источник
V. Бактериофаги
Бактериофаги– это стерильные фильтраты бульонной культуры соответствующих микробов, лизированных фагом, содержащие живые частицы и растворенные антигены бактерий, освободившиеся из клеток при их лизисе.
Полифаги – фаги, лизирующие близкородственные бактерии.
Монофаги – фаги, способные взаимодействовать с бактериями одного вида (видоспецифические).
Типовые фаги – фаги, вызывающие лизис отдельных вариантов (типов) определенного вида бактерий.
Лечебно-профилактические – применяют для профилактики и лечения, местно в виде орошения, полоскания, примочек путем аппликации на раневую или ожоговую поверхность и парентерально, фаги можно вводить энтерально (через рот и ректально), в полости: брюшную, плевральную, суставную и в полостные органы. Защитное свойство фага длиться 5-7 суток.
Диагностические – применяют в диагностической практике с целью идентификации чистой культуры возбудителя, выделенного от больного до вида (фагоидентификация), до фаговара (фаготипирование), а также для косвенного определения патогенных микроорганизмов в объектах внешней среды и патологическом материале при постановке реакции нарастания титра фага (РНТФ).
Вводить диагностические бактериофаги в организм человека категорически запрещается!
Для фагоидентификации бактерий в объектах окружающей среды применяют индикаторные бактериофаги. Индикаторный бактериофаг – вирулентный фаг, характеризующийся точно лимитированным спектром действия. Индикаторный фаг обладает высокой адсорбционной способностью, коротким инкубационным периодом и высоким урожаем. Эти свойства обеспечивают значительное увеличение титра фага в исследуемом материале, содержащем соответствующих возбудителей, что выявляется в РНТФ.
Для фаготипирования бактерий в чистой культуре применяют типовые бактериофаги. Типовые бактериофаги– это фаги, выделенные из лизогенных культур. При типировании бактерий используют умеренные фаги, обладающие литической активностью в критических тест-разведениях, то есть в максимальных десятикратных разведениях, которые дают сливной лизис гомологичного штамма бактерий на плотной питательной среде. Такие фаги позволяют дифференцировать возбудителей на большое количество фаготипов.
Схема описания препарата:
С: Стерильный фильтрат фаголизата бульонной культуры соответствующих
Пр:а) Экстренная профилактика и терапия заболевания
б) Бактериологический метод – для реакции фаготипирования, фагоидентификации, фагоиндикации (на ампуле: название фага, титр / слово «индикаторный»)
СПр:а) Перорально в виде орошений и примочек, инъекций (не внутривенно), введение в полость
б) Для постановки . (указать реакцию).
VI. Пробиотики
Пробиотики – это препараты, содержащие живые бактерии симбиотической микробиоты кишечника человека (бифидобактерии, лактобактерии, кишечная палочка) или самоэлиминирующиеся антагонисты (бактерии рода Bacillus и дрожжи), оказывающие при естественном способе введения благоприятные эффекты на физиологические функции, биохимические и поведенческие реакции организма хозяина через оптимизацию его микробиологического статуса.
Пробиотики используются для восстановления нормального микробиоценоза после длительного лечения антибиотиками, при кишечных инфекциях и дисфункциях (особенно у детей), при аллергических состояниях и т.д.
Эубиотики– состоят из лиофилизированной микробной массы представителей симбиотической микробиоты кишечника человека (бифидобактерии, лактобактерии, кишечная палочка).
Пробиотики-самоэлиминирующиеся антагонисты – состоят из лиофилизированной микробной массы непатогенных представителей рода Bacillus и лечебных дрожжей, не являющихся представителями нормальной микробиоты человека.
Рекомбинантные – состоят из лиофилизированной микробной массы, содержащей рекомбинантные бактерии рода Bacillus, со встроенным геном, контролирующим синтез -интерферона.
Пребиотики– состоят из веществ немикробного происхождения, не адсорбирующихся в верхних отделах пищеварительного тракта, способны стимулировать рост или метаболическую активность нормальной микробиоты кишечника. Чаще всего пребиотики содержат низкомолекулярные углеводы (олигосахариды).
Монокомпонентные – состоят из лиофильно высушенной взвеси живых микроорганизмов – представителей нормальной микробиоты человека.
Поликомпонентные – состоят из высушенной взвеси совместно выращенных антагонистически активных живых микроорганизмов – представителей нормальной микробиоты человека.
Комбинированные – состоят из лиофилизированной взвеси живых микроорганизмов и ферментов (лизоцим и др.).
Синбиотики– препараты, представляющие собой комбинации пробиотиков и пребиотиков.
Схема описания препарата:
ДН: а) Продукты обмена веществ бактерий соответствующего вида
б) Олигосахариды немикробного происхождения
С:а) Лиофильно высушенная взвесь живых бактерий в среде культивирования
б) Низкомолекулярные вещества немикробного происхождения из различных природных субстратов
Пр: Для коррекции и профилактики дисбиозов, терапии ОКИ
Источник
Бактериофаги: современные аспекты применения, перспективы на будущее
Бактериофаги – уникальные микроорганизмы, на основе которых создана особая по своим свойствам и характеристикам группа лечебно-профилактических препаратов. Лежащие в основе их действия природные физиологические механизмы взаимодействия фагов и бактерий позволяют прогнозировать бесконечное разнообразие как самих бактериофагов, так и возможных способов их применения. По мере расширения коллекций бактериофагов, несомненно, будут появляться новые целевые патогены, будет расширяться спектр заболеваний, при которых фаги могут применяться как в режиме монотерапии, так и в составе комплексных схем лечения.
Так, использование поливалентного пиобактериофага Секстафаг при лечении инфицированного панкреонекроза (Пермская государственная медицинская академия им. академика Е.А. Вагнера) позволило быстрее восстанавливать у больных основные параметры гомеостаза и функции органов и систем. Также значительно снизилось количество послеоперационных осложнений и летальных исходов: в группе больных, получавших стандартную терапию, летальность составила 100%, в то время как в труппе, получавшей БФ, — 16,6% [22].
Вследствие безвредности и ареактогенности препаратов БФ возможно их применение в педиатрической практике, в т. ч. и у новорожденных детей. Интересен опыт Нижегородской детской областной клинической больницы, где в период осложнения эпидемиологической ситуации наряду с обычными противоэпидемическими мероприятиями были использованы и БФ — Интести-бактериофаг и БФ Pseucfomonas aeruginosa. Снижение заболеваемости внутибольничной инфекцией синегнойной этиологии в 11 раз показало высокую эффективность применения БФ [20]. Препараты БФ могут назначаться как для лечения дисбактериоза и расстройств пищеварительной системы, так и для предотвращения колонизации слизистых оболочек желудочно-кишечного тракта условно-патогенными бактериями. Поликомпонентные препараты БФ идеальны для немедленного купирования первых признаков расстройства желудочно-кишечного тракта.
На сегодняшний день на предприятии намечен целый ряд приоритетных направлений разработки и производства лечебно-профилактических бактериофагов, которые коррелируют с вновь зарождающимися общемировыми тенденциями. Создаются и внедряются новые препараты: разработаны БФ против серраций и энтеробактерий, ведутся работы по созданию фагового препарата против Helicobacter pylori.
Лишь один производитель этих препаратов – НПО «Микроген», по докладу замглавы управления науки и инновационного развития Аллы Лобастовой, выпускает более 2 млн упаковок ежегодно [9]. К сожалению, представления многих врачей о бактериофагах далеки от объективности. Не многие знают, что бактериофаги, активные в отношении одного и того же возбудителя, могут относиться к разным семействам, обладать различным жизненным циклом и т. п. Так, например, бактериофаги P. aeruginosa относятся к семействам Myoviridae, Podoviridae, Siphoviridae, имеют литический жизненный цикл или умеренный. Разные штаммы одного и того же патогена могут обладать различной чувствительностью к бактериофагам. Большинство специалистов знают (слышали, кто-то применял) о существовании жидкой и таблетированной лекарственной формы лечебно-профилактических препаратов бактериофагов. Однако их спектр существенно шире, что может быть отнесено к безусловным преимуществам, особенно в сочетании с многообразием путей введения (прием внутрь, введение в клизмах, аппликации, орошение ран и слизистых оболочек, введение в раневые полости и т. п.) [10]. К очевидным преимуществам бактериофагов традиционно относят специфическое воздействие на достаточно ограниченную популяцию бактерий, ограниченное во времени существование (пока не исчезнет целевая популяция микроорганизмов), отсутствие таких побочных эффектов, как токсические и аллергические реакции, дисбиотические реакции и др. Эти препараты могут применяться в самых разных возрастных группах и при беременности [11, 12]. Сами бактериофаги не являются значимыми аллергенами. Случаи непереносимости препаратов бактериофагов связаны в своем большинстве с реакцией на компоненты питательной среды. Все крупные производители этой группы препаратов стремятся к максимальному качеству используемых компонентов, что уменьшает вероятность таких реакций. В условиях роста антибиотикорезистентности некоторые авторы [13] предлагают рассматривать бактериофаги как наилучшую альтернативу антибиотикам. Лечебно-профилактические препараты бактериофагов представляют собой коктейль из специально подобранных комбинаций (комплекс поликлональных высоковирулентных бактериальных вирусов, специально подобранных против наиболее часто встречающихся групп возбудителей бактериальных инфекций) на основе коллекций фагов производителя [14]. Филиалы ФГУП «НПО «Микроген» в Уфе, Перми и Нижнем Новгороде – современные центры производства таких препаратов. Возможность создания адаптированных к конкретным патогенным микроорганизмам лечебно-профилактических препаратов бактериофагов – еще одно важнейшее преимущество этой группы препаратов. Рост устойчивости бактерий к антимикробным препаратам и часто встречающаяся полиэтиологичность современных инфекционных заболеваний требуют проведения комбинированной антибиотикотерапии (двух, трех, а иногда и более антимикробных препаратов). Для выбора эффективной схемы терапии антибиотиками, помимо собственно чувствительности бактерии к препарату, необходимо учесть достаточно большое число факторов. Фаготерапия в этом отношении также имеет определенные преимущества. С одной стороны, применение комбинации бактериофагов не сопровождается их взаимодействием между собой и не ведет к изменению схем их применения. В рамках имеющегося набора лечебных бактериофагов существуют ряд хорошо себя зарекомендовавших комбинаций – бактериофаг колипротейный, пиобактериофаг поливалентный, интести-бактериофаг. С другой стороны, бактерии не имеют общих механизмов устойчивости к антибиотикам и фагам, следовательно, могут они применяться как при устойчивости патогена к одному из препаратов, так и в комбинации «антибиотик + бактериофаг». Особенно эффективна такая комбинация для разрушения микробных биопленок. В эксперименте убедительно показано, что комбинированное применение антагонистов железа и бактериофага способно нарушать формирование биопленок Klebsiella pneumoniae [15]. При этом отмечается как достоверное уменьшение численности микробной популяции, так и уменьшение числа «молодых» клеток. Еще одной важной особенностью действия бактериофагов является такой феномен, как индукция апоптоза. Некоторые штаммы E. coli имеют гены, вызывающие гибель клетки после внедрения в нее бактериофага Т4 [16]. Так, в ответ на экспрессию поздних генов фага Т4 ген lit (кодирует протеазу, разрушающую необходимый для синтеза белков фактор элонгации EF-Tu [17]) блокирует синтез всех клеточных белков. Ген prrC кодирует нуклеазу, расщепляющую лизиновую тРНК. Нуклеаза активируется продуктом гена stp фага Т4. У инфицированных фагом Т4 клеток гены rex (относятся к геному фага и экспрессируются в лизогенных клетках) вызывают формирование ионных каналов, ведущих к потере клетками жизненно важных ионов и впоследствии к гибели. Предотвратить гибель клетки может сам фаг Т4, закрывая каналы своими белками, продуктами генов rII [18]. В случае формирования устойчивости бактерий к антибиотику приходится искать новые варианты модификации активной молекулы или принципиально новые вещества. К сожалению, за последние годы темпы внедрения новых антибиотиков существенно замедлились. Ситуация с бактериофагами принципиально иная. Коллекции крупных производителей насчитывают десятки готовых штаммов бактериофагов и постоянно пополняются новыми активными фагами [19]. Благодаря постоянно проводимому мониторингу чувствительности выделяемых патогенов к бактериофагам производители корректируют поставляемые в регионы фаговые композиции [20]. Благодаря адаптированным бактериофагам удается ликвидировать вспышки внутригоспитальных инфекций, вызываемых резистентными к антибиотикам штаммами [21]. 
При пероральном приеме бактериофаги быстро достигают очагов локализации инфекции: при пероральном приеме больными с гнойно-воспалительными заболеваниями уже через час фаги попадают в кровь, через 1–1,5 ч выявляются из бронхолегочного экссудата и с поверхности ожоговых ран, через 2 ч – из мочи, а также из ликвора больных с черепно-мозговыми травмами [14].
Источник