- Классификация аппликационных лекарственных форм
- ТРАНСДЕРМАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ И ИХ МЕСТО В ФАРМАЦЕВТИЧЕСКОМ СЕКТОРЕ
- АССОРТИМЕНТ И ХАРАКТЕРИСТИКИ ТРАНСМУКОЗАЛЬНЫХ ЛЕКАРСТВЕННЫХ ФОРМ (АССОРТИМЕНТ ЛЕКАРСТВЕННЫХ ПЛЕНОК)
- Полный текст:
- Аннотация
- Ключевые слова
- Об авторах
- Список литературы
- Для цитирования:
- For citation:
Классификация аппликационных лекарственных форм
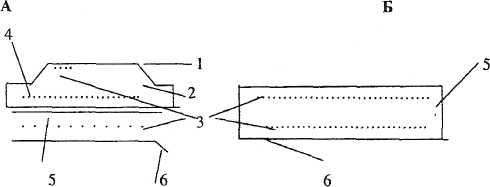
ТТС делят на две группы: матричные и мембранные (равиоли) (рис. 3).
Матричные ТТС. В них лекарственное вещество растворено или диссоциировано во всем объеме полимерного тела, т.е. помещается в матрицу, состоящую из геля или полимерной пленки. Высвобождение ЛВ из такой системы определяется его диффузией из материала матрицы.
Рис. 3. А — мембранная ТТС (равиоли), Б — матричная ТТС: 1 — покровная пленка,
2 — резервуар, 3 — молекулы ЛВ, 4 — мембрана, 5 — матрица, 6 — защитная адгезионная пленка (удаляется перед аппликацией на кожу)
Мембранные ТТС (известные в зарубежной практике как равиоли) — состоят из непроницаемой подложки, резервуара с лекарственным веществом, мембраны, регулирующей высвобождение лекарственного средства и адгезивного (клейкого) слоя (т.е. лекарственное вещество находится в резервуаре в виде суспензии в жидкости или геле, покрытого полимерной мембраной) [70]. Резервуар располагается между непроницаемой подложкой и мембраной из пористой полимерной фольги, которая определяет скорость высвобождения лекарственного вещества. Это так называемые мембранные пластыри (или резервуарные мембранные системы).
Структура и механизм высвобождения лекарственных веществ из различных ТТС представлены на рис. 4 и 5.
Однако ТТС классифицируют и по другим признакам.
Так, с целью унификации терапевтических систем, предлагаемых для стоматологии, С.С. Хмелевская и соавт. предлагают использовать классификацию, аналогичную классификации офтальмологических препаратов этого типа:
матричные (с высвобождением ЛВ посредством диффузии);
эродирующие (высвобождение ЛВ осуществляется путем диффузии с одновременной эрозией терапевтической системы);
резервуарные (с диффузией активного ингредиента через мембраны);
Подобная классификация предложена и для терапевтических систем, используемых интравагинально
Используется и другой тип классификации ТТС — по способу воздействия на макро-организм:
местного (локального) действия;
резорбтивного (общего) воздействия.
Согласно классификации Н. Ламбова (1987), ТТС обычно делят на две группы, различающиеся по принципам, обусловливающим их физиологическую активность. В первой группе используется физиологическая активность самих ТТС. Механизм действия не связан с их распадом, а обусловлен свойствами макромолекулы (например, на основе полипептидов). Ко второй группе относятся ТТС, в которых низкомолекулярное лекарственное вещество присоединено («привито») тем или иным способом к полимерной цепи (лекарственные пленки привитого» типа). Их можно рассматривать как сложные полимерные системы, которые обладают физиологической активностью, зависящей от присоединенного лекарственного вещества
По типу связи молекул действующих веществ с носителем различают 4 варианта, которые отличаются различной динамикой выделения действующего начала:
молекулы лекарственного вещества включены в основную цепь полимера;
лекарственное вещество присоединено ковалентной связью к боковой цепи полимера;
лекарственный препарат включен в сферическую или цилиндрическую оболочку с целью имплантации или перорального применения (отсутствие химической связи с полимером);
лекарственный препарат равномерно распределен в растворе полимера или в блоке полимера в виде твердого раствора, или растворен в растворе полимера (отсутствие ковалентной связи)
С учетом активных исследований, проводимых (особенно в нашей стране) при создании матричных ТТС в виде лекарственных пленок (ЛП), можно дать и другую классификацию:
ТТС — лекарственные пленки, которые, в свою очередь, делятся так:
а — ЛП с синтетическими веществами;
б -ЛП с веществами природного (растительного) происхождения.
В настоящее время обе группы ТТС по этой классификации представлены достаточно разнообразным ассортиментом лекарственных пленок, который также требует самостоятельной характеристики, особенно подгруппа б.
Лекарственные пленки, содержащие биологически активные соединения растительного происхождения, получившие неофициальное название фитопленки (ФП) [76-80, 89-96], являются разновидностью ТТС. Отличаются от синтетических полимерных терапевтических систем тем, что ФП изготавливают в виде матричных ТТС на носителях природного происхождения (желатин, коллаген, альгинат натрия, агар-агар и др.), что делает их более безопасными и совместимыми с живым организмом. Кроме указанных отличий, лекарственные пленки, как правило, не содержат адгезивного слоя, а их сцепление с наносимой поверхностью происходит за счет вязкостных свойств матрицы-носителя, в то время как традиционные макромолекулярные ТТС выпускают в виде пластырей или лент с обязательным наличием адгезивного (клейкого) слоя.
ФП представляют собой тонкие липкие пластинки различных размеров с извлечениями из лекарственного растительного сырья, введенных в состав пленкообразователей. Толщина пленок не превышает 5 мм. Они предназначены для оказания местного или резорбтивного воздействий и представляют собой матричные ТТС.
ФП можно подразделять на следующие группы:
• по конструктивным особенностям:
ФП монослойные (монолитные);
ФП бислойные (многослойные);
• по числу лекарственных компонентов:
Рациональной является и классификация ФП по поведению в очаге патологии (по способу рассасывания): I. Биодеструктирующие (рассасывающиеся):
П. Бионедеструктирующие (требующие извлечения, удаления).
Биодеградируемые ФП отличаются от биоэродируемых характером растворения. Если деструкция ТТС идет за счет эрозии поверхности, то ее называют биоэродируемой. Если же внешняя среда быстро проникает в полимер и деструкция протекает во всем объеме полимера, то в этом случае имеют дело с биодеградируемой ТТС [70, 87].
Возможны 4 различных механизма биодеструкции:
диссоциация полимер-полимерных комплексов (ППК);
растворение или неспецифический гидролиз полимеров в тканевых жидкостях;
4) межмолекулярный катализ расщепления ППК или внутримолекулярное расщепление водонерастворимых полимеров с образованием растворимых фрагментов
Однако все вышеприведенные типы классификаций носят весьма условный характер. На наш взгляд, в качестве основной (или рабочей) можно считать классификацию лекарственных ФП по области их применения (или по месту их нанесения):
дерматологические (в том числе хирургические);
По дисперсологической классификации лекарственные 4 можно отнести к связно-дисперсным системам с условно твердой дисперсионной средой и дисперсной фазой [135].
Если рассматривать ФП с позиции механизма пролонгирования, который в настоящее время делят на две группы (поддерживающего и повторного действия), то их можно отнеси лекарственным формам поддерживающего действия (sustan release) [147]. Такой механизм пролонгирования является более приемлемым, если речь идет, в частности, об антимикробных лекарственных средствах. И в то же время для ФП тонизирующего, стимулирующего действия более приемлем механизм повторного действия (repeat release).
Таким образом, лекарственная фитопленка, наряду с пол мерными ТТС, стала терапевтической единицей в системе классификации лекарственных форм для чрескожного введения лекарственных веществ.
Источник
ТРАНСДЕРМАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ И ИХ МЕСТО В ФАРМАЦЕВТИЧЕСКОМ СЕКТОРЕ
УДК 615.454.122.014.015
З.Б. Сакипова, С. К. Жетерова, Р. М. Блатов
Казахский Национальный Медицинский Университет имени С.Д. Асфендиярова
В статье говорится о появлении и использовании трансдермальных терапевтических систем в современной медицинской практике, преимуществах их применения в сравнении с традиционными лекарственными формами. Представлен обзор ТТС зарегистрированных в мире, России и Казахстане и проведен анализ объема рынка ТТС в мире и актуальности их применения.
Во многих клинических ситуациях доставка лекарственных веществ с помощью трансдермальной терапевтической системы оказывается удобным и безопасным методом фармакотерапии и зачастую представляет привлекательную альтернативу пероральным лекарственным формам.
Ключевые слова: трансдермальные терапевтические системы, трансдермальная доставка
Начиная с первых этапов развития фармации и вплоть до XX века, лекарственная форма (ЛФ) не представляла специального клинического интереса, поскольку эффективность препарата связывалась только с наличием в нем действующего лекарственного вещества (ЛВ) и его дозой.
С развитием аналитических методов контроля препаратов и определения действующих веществ в биологических жидкостях получены данные, указывающие на зависимость скорости всасывания ЛВ, их концентрации, характера распределения в тканях и органах от вида ЛФ и пути ее введения [1]. Некоторые ЛВ, активные в форме ингаляций, не действуют при пероральном приеме. Другие вещества, активные парентерально, в значительной мере разрушаются в кислой среде желудка. ЛФ должны использоваться в первую очередь для создания оптимальных условий действия ЛВ. Значительные изменения произошли в последней трети XX века, когда А. Дзаффарони была разработана концепция технологии контролируемого высвобождения действующего начала из ЛФ.
Среди различных систем доставки лекарственных веществ – пероральных (осмотические мининасосы), парентеральных (наночастицы и нанокапсулы), субкутальных (имплантанты), внутриполостных (внутриматочные инсерты и свечи), и т.д. – наибольшее распространение и коммерческий успех получили трансдермальные терапевтические системы (ТТС) [2], нанесение которых предполагается как на кожу, так и на слизистые оболочки [3]. Они предназначены для непрерывной подачи содержащихся в них ЛВ через неповрежденную кожу в системное кровообращение в течение длительного времени с заранее заданной скоростью 4. ТТС принадлежат к новому поколению ЛФ, в которых используется технология контролируемого высвобождения ЛВ. Она основана на том, что ЛВ непрерывно подается в организм со скоростью, создающей в кровотоке постоянный уровень концентрации ЛВ, близкий к минимальному терапевтическому уровню. В отличие от этого уровень концентрации ЛВ при использовании традиционных лекарственных форм имеет пики, которые могут достигать токсического уровня, когда проявляются побочные эффекты [2]. Использование трансдермальных лекарственных форм в сравнении с пероральными позволяет снизить терапевтическую дозу лекарственных веществ, за счет отсутствия инактивации или снижения активности лекарства в результате «эффекта первого прохождения», желудочного, кишечного и печеночного метаболизма [6, 7] и минимизировать риск развития гастроинтестинальных побочных реакций. Это особенно важно при применении таких нестероидных противовоспалительных лекарственных препаратов, как ацетилсалициловая кислота, индометацин, диклофенак, кетопрофен и другие.
В последние десятилетия Всемирная организация здравоохранения (ВОЗ) уделяет все большее внимание актуальной проблеме – побочным действиям и осложнениям в результате приема лекарственных средств (ЛС). ВОЗ координирует и поддерживает деятельность национальных центров по контролю безопасности лекарств в более чем 80 странах, участвующих в Международной программе по мониторингу лекарств, в том числе и в Казахстане.
Согласно мониторингу побочных действий ЛС в период с мая 2005 по сентябрь 2010г., за 5 лет было зарегистрировано 2469 карт-сообщений о побочных действиях ЛС, выявленных на территории Республики Казахстан. Из них, на лекарственные препараты отечественных производителей – 1123, зарубежного производства – 1346 карт-сообщений. При этом сообщений о серьезных побочных действиях с угрозой для жизни было 86, с летальным исходом – 22 [8]. Доказывает высокий темп роста возникновения побочных действий ЛС и то, что по данным Национального Центра Экспертизы Лекарственных Средств Министерства Здравоохранения РК на 30 ноября 2012г. поступило уже 3 960 карт-сообщений о побочных действиях лекарственных средств [9].
Так, затраты, связанные с лекарственными осложнениями, составляют в разных странах от 5 до 17% от общих затрат на здравоохранение [10] и использование новых лекарственных форм, позволяющих снизить риск развития побочных действий является экономически целесообразным.
На сегодняшний день для целого ряда препаратов трансдермальная доставка стала реальностью. К примеру, в лечении сердечно-сосудистых заболеваний с успехом используются пластыри нитроглицерина и клонидина: в первом случае трансдермальное назначение позволяет поддерживать необходимую системную концентрацию в крови в течение 10–12 часов, во втором — на протяжении семи дней. Для сравнения оральное назначение клонидина требует 2–3-разового приема [11]. Для купирования хронических болей у онкологических больных применяется трансдермальная форма фентанила, обеспечивающая длительную — трехдневную анальгезию [12].
ТТС становятся популярными во всем мире. Согласно данным последних лет и специальному отчету компании PharmaLive, что отражено на диаграмме и в таблице 1, с 2005г. наблюдается ежегодный двухзначный рост объема продаж ТТС на мировом рынке и, исходя из прогнозов, к 2015 году объем рынка увеличится почти в 1,5 раза и достигнет 31,5 миллиарда долларов [13,14].
В таблице 2 перечислены трасндермальные препараты, зарегистрированные в России, причем более 80% из них представлены на рынке РФ с 2008 года [15].
Таблица 2 — ТТС, зарегистрированные в России (Реестр лекарственных средств, 2012)
Источник
АССОРТИМЕНТ И ХАРАКТЕРИСТИКИ ТРАНСМУКОЗАЛЬНЫХ ЛЕКАРСТВЕННЫХ ФОРМ (АССОРТИМЕНТ ЛЕКАРСТВЕННЫХ ПЛЕНОК)
Полный текст:
Аннотация
Ключевые слова
Об авторах
Список литературы
1. П.Г. Мизина, В.А. Курикин, В.В. Косарев и др. // Патент РФ № 2155071. Способ получения лекарственной фитопленки. Выд. 27.08.2000 г.
2. Т.Ф. Маринина, Л.Н. Савченко, Ю.Г. Пшуков и др. Лекарственные пленки: Учебное пособие. — Пятигорск, 2003. 44 с.
3. П.Г. Мизина, В.А. Быков. Чрескожное введение лекарственных средств: современные аппликационные лекарственные формы: Учебное пособие. Самара, 2004. 124 с.
4. M.R. Baichwal, S.G. Deshpande, P.K. Singh, P. Venkitachalam. Studies onpolymeric films for transdermal use // Jnd. J. Pharm. Sci. 1988. V. 50. № 3. P. 153-156.
5. П.Г. Мизина, С.Н. Бабкин и др. Исследование токсичности лекарственных фитопленок // Человек и лекарство: Тез. докл. 4 Рос. нац. конгр. 8-12 апр. 1997. М., 1997. С. 84.
6. П.Г. Мизина, Н.П. Гурина и др. Лекарственные фитопленки — рациональная лекарственная форма // Человек и лекарство: Тез. докл. 4 Рос. нац. конгр. 8-12 апр. 1997г. М., 1997. С. 331.
7. П.Г. Мизина. Фитопленки в фармации и медицине / П.Г. Мизина // Фармация. 2002. № 5-6. С. 38-40.
8. Лекарственные средства, применяемые в стоматологии (X формулярная система). — Новая аптека. Нормативнаяе документы. 2002. № 9. С. 82-96.
9. Л.Н. Ерофеева, Н.Д. Афонина и др. Пленки с мирамистином для профилактики и лечения травматического ринита // Достижения, проблемы и перспективы фармацевтической науки и практики: Матер. регион. научно — практич. конф. (с международ. участием), посвященный 40-летию фармац. факультета КГМУ / Под. ред. А.И. Лазарева. — Курск: КГМУ, 2006. С. 158-161.
10. А.А. Спасов. Магний в медицинской практике / А.А. Спасов. — Волгоград: ООО «Отрон», 2000. 272 с.
11. Государственный реестр лекарственных средств. http://www.grls.rosminzdrav.ru (дата обращения 19.04.2017).
12. Е.Ю. Симановская, Л.Н. Олешко, Г.И. Олешко Использование биорастворимых лекарственных пленок в детской стоматологической практике // Рациональное использование лекарств: Матер. Росс. науч. — практич. конф. (10-12 марта 2004 года, Пермь). Пермь, 2004. С. 274-276.
13. С.О. Лосенкова, А.В. Крикова Лекарственные пленки. Учебно-методическое пособие. — Смоленск: СГМА, 2007.
14. Полимеры в фармации // Под ред. А.И. Тенцовой и М.Т. Алюшина. М: Медицина, 1985. 250 с.
15. Т.Ф. Маринина, Л.Н. Савченко и др. Исследование по созданию стоматологических лекарственных пленок с левомецитином и метилурацилом // Разработка, исследования и маркетинг новой фармацевтической продукции: Матер. 61-й межрегион. конф. по фармации и фармакологии: сб. науч. тр. Пятигорск, 2006. С. 114-116.
16. В.И. Погорелов, Т.Ф. Маринина, Л.Н. Савченко и др. Основные принципы разработки стоматологических лекарственных форм // Разработка, исследования и маркетинг новой фармацевтической продукции: Матер. 58-й межрегион. конф. по фармации и фармакологии: сб. науч. тр. — Пятигорск, 2003. С. 148-150.
17. Е.Н. Карпенко, Л.Н. Ерофеева и др. Разработка полимерных лекарственных пленок с доксорубицином // Фармация. 2006. С. 18-21.
18. Т.Н. Юданова, И.В. Решетов Современные раневые покрытия: получение и свойства (обзор) // Химико — фармац. журнал. Т. 40. № 2. 2006. С. 24-31.
19. М.Б. Умерзакова, Ж.К. Мустафина, Г.И. Бойко, Б.А. Жубанов и др. Полимерные лекарственные пленки с пилокарпином и витаминами // Хим. — фарм. ж. 1999. Т. 33. № 3. С. 49-50.
20. М.Б. Сапожникова, Ю.А. Обидченко и др. Исследование биодоступности ибупрофена в виде быстрорастворимой трансбуккальной пленки // Фармация. 2014. № 5. С. 47-50.
Для цитирования:
Шестаков Н.В., Лосенкова С.О., Закалюкина Е.В., Степанова Э.Ф. АССОРТИМЕНТ И ХАРАКТЕРИСТИКИ ТРАНСМУКОЗАЛЬНЫХ ЛЕКАРСТВЕННЫХ ФОРМ (АССОРТИМЕНТ ЛЕКАРСТВЕННЫХ ПЛЕНОК). Разработка и регистрация лекарственных средств. 2017;(2):96-101.
For citation:
Shestakov N.V., Losenkova S.O., Zakalyukin E.V., Stepanova E.F. RANGE AND CHARACTERISTICS TRANSMUCOSAL DOSAGE FORMS. Drug development & registration. 2017;(2):96-101. (In Russ.)

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Источник