- Производные пурина. Фармацевтический анализ пурина
- Нарушения пуринового обмена
- Оглавление
- 1. Пуриновый обмен
- 1.1. Синтез пуринов de Novo
- 1. Синтез 5′-фосфорибозиламина
- 2. Синтез инозинмонофосфата
- 3. Синтез аденозинмонофосфата и гуанозинмонофосфата
- 4. Образование нуклеозидтрифосфатов АТФ и ГТФ.
- Образование дезоксирибонуклеотидов
- 1. Реакция дефосфорилирования
- 2. Реакция восстановления
- 3. Реакция фосфорилирования
- Тиоредоксины
- 1.2. Переваривание нуклеиновых кислот и резервные источники пуриновых оснований
- 1.3. Регуляция пуринового обмена
- 2. Нарушения пуринового обмена
Производные пурина. Фармацевтический анализ пурина
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Производные пурина. Фармацевтический анализ пурина
Глава 16. Анализ лекарственных средств группы пурина
В природе производные пурина имеют большое биологическое значение. Соединения группы пурина содержатся в растениях и тканях животных в свободном виде, а также входят в состав нуклеозидов, нуклеотидов и нуклеиновых кислот.
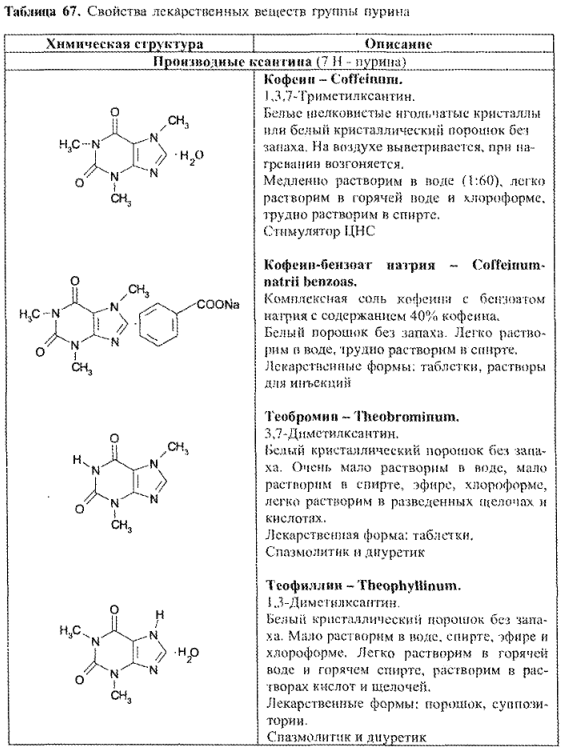
Кофеин содержится в листьях чая (до 5%) и зернах кофе (до 1,5%). Впервые кофеин выделен и описан Ф. Рунге (1819); строение этого алкалоида доказано Э. Фишером в 1882 г. В листьях чая содержится также теофиллин, а в бобах какао – теобромин.
Нуклеиновые кислоты присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению и передаче генетической информации.
К производным пурина относится большая труппа лекарственных веществ, обладающих рахтичной фармакологической активностью — бронхолитической, диуретической, кардиотонической, противоопухолевой, действием на ЦНС.
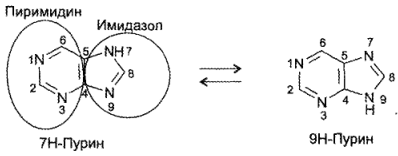
В основе химической структуры указанных лекарств лежит бициклическая система пурина, существующая в виде 2 изомеров:
ЛС — производные пурина по химическому строению разделяются на следующие группы:
- производные ксантина;
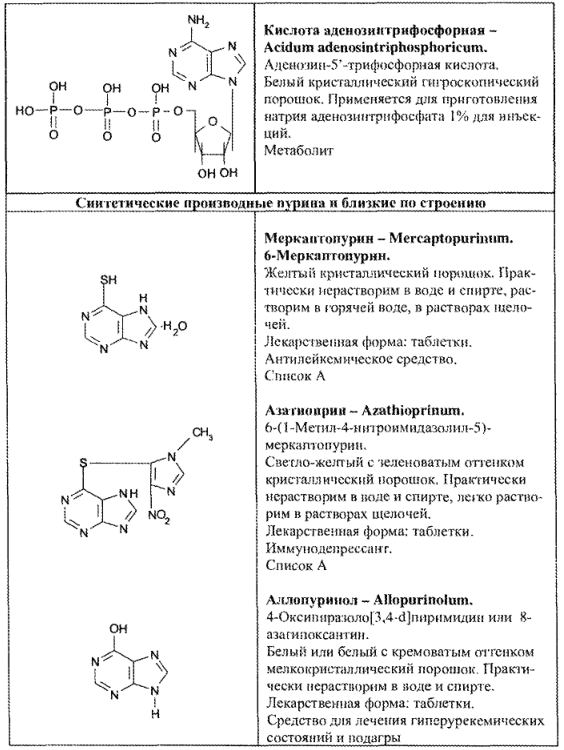
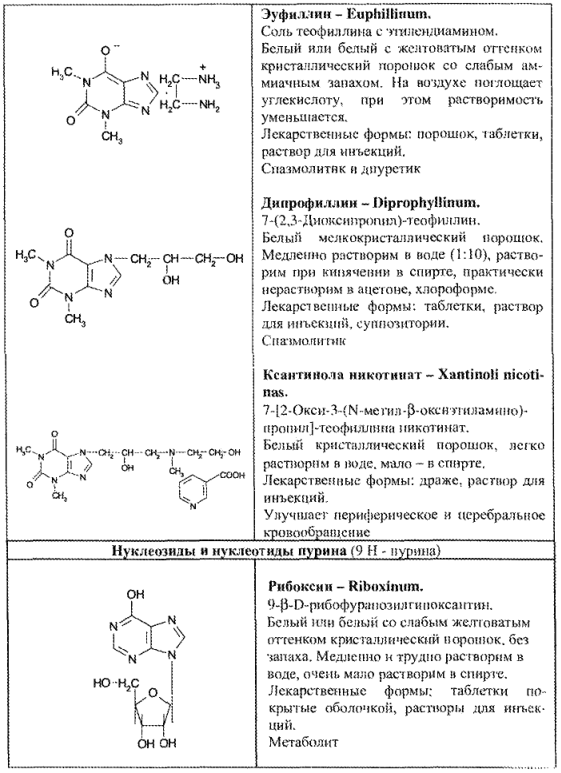
- нуклеозиды и нуклеотиды пурина (рибоксин, АТФ, динатриевая соль аденозинтрифосфорной кислоты);
- синтетические производные пурина и близкие по строению (табл. 67).
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА И АНАЛИЗ КАЧЕСТВА
Физические свойства
Все соединения группы пурина – кристаллические порошки белого цвета с характерными Тпл и спектрами поглощения в УФ- и ИК-областях.
Способы получения
Вещества группы пурина можно получать из природных источников и синтетически. Пуриновые алкалоиды (кофеин, теофиллин, теобромин) — растительного происхождения.
С конца XIX в. успешно развиваются различные методы синтеза пурина и его производных. Впервые пурин был синтезирован Э. Фишером в 1899 г. при восстановлении 2,6,8-трихлорпурина. В настоящее время наибольшее практическое значение имеют 4 способа синтеза пуринов:
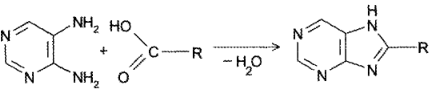
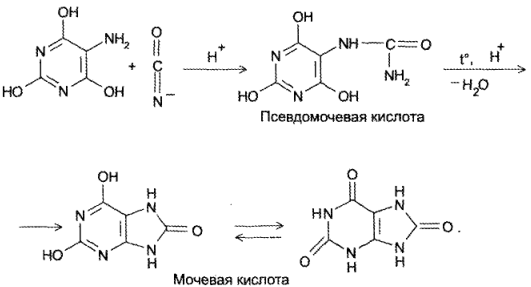
- Конденсация 4,5-диаминопиримидинов с карбоновыми кислотами (синтез Траубе, 1910). Этот способ в дальнейшем многократно модифицировался и до сих пор не утратил своего значения:
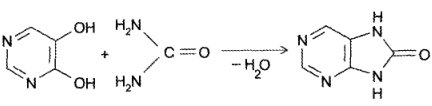
- Конденсация 4,5-диоксипиримидинов с. мочевиной (Беренд, Розен, 1888):
- Присоединение цианатов или изотиоцианатов к 5-амино-2,4,6- гриоксиоксипиримидину с последующей циклизацией образующегося карбамида пои нагревании в кислой среде (Э. Фишер, Аш, 1895):
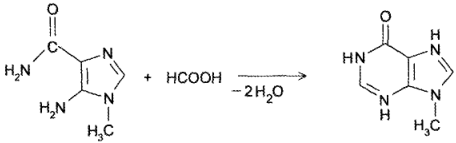
- Конденсация амида 5-амино-1-метилимидазол-4-карбоновой кислоты с муравьиной кислотой:
Кислотно-основные свойства
Пурин — ароматическая система с сильной делокализацией тг-электронов, которые играют большую роль в образовании различных молекулярных комплексов. Он обладает электронодонорными свойствами и представляет собой растворимое в воде слабое основание (рКа = 2,4), образующее с кислотами непрочные соли. В то же время благодаря наличию подвижного атома водорода в NН- группе пурин проявляет слабые кислотные свойства (рКа – 8,9) и образует соли с металлами.
Лекарственные вещества группы пурина — слабые основания, образующие с кислотами неустойчивые соли при протонировании гетероатома азота в 9-м положении.
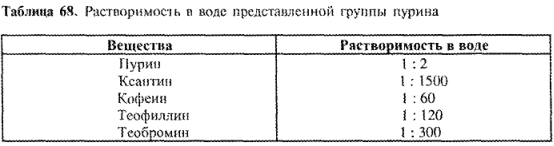
Как правило, производные ксантина с трудом растворяются в воде (лучше — в горячей). Для получения хорошо растворимых лекарственных препаратов используется их способность к комплексообразованию. Данные о растворимости различных веществ группы пурина представлены в табл. 68:
Хорошая растворимость пурина объясняется тем, что он образует водородные мостики с молекулами воды. Особенно мала растворимость ксантина. При метилировании атомов азота она значительно улучшается, как видно на примере кофеина, теофиллина, теобромина. Различия в растворимости объясняются разной межмолекулярной ассоциацией.
У кофеина 3 гетероатома азота метилированы. Вещество является мономером (не образует ассоциатов через водородные мостики), что объясняет его лучшую растворимость и низкую Тпл. Растворимость кофеина увеличивается в горячей воде, а также в присутствии солей органических кислот (за счет образования комплексов).
В теофиллине имеется одна свободная, но мало активная NН- группа, способная образовывать слабые межмолекулярные водородные мостики. Как в твердом состоянии, так и в растворе предполагается димеризация. Это подтверждается меньшей, чем у кофеина, растворимостью и более высокой Тпл.
Теобромин в твердом состоянии образует еще большие межмолекулярные агрегаты, основанные на активной NН-группе и выгодных в пространственном отношении карбонильных группах. Плохую растворимость и высокую Тпл можно также объяснить этой стабильной ассоциацией, что доказано ПК-спектроскопией.
Тенденция ксантинов к «самокомплексообразованию» противостоит их предрасположенности к образованию комплексов с солями органических кислот (бензойной, салициловой, 4
аминобензойной, ацетилсалициловой и др.).
Кофеин — слабое органическое основание (рКa. = 0,61). Растворим в минеральных кислотах, но устойчивых солей не образует. Взаимодействует с общеалкалоидными осадительными реактивами. Но с раствором йода реагирует только при подкислении (что характерно для такого слабого основания) с образованием осадка перйодида (Соff*Cl*14 ). С танином кофеин образует осадок, растворимый в избытке реактива. В отличие от многих других оснований кофеин не осаждается реактивом Майера, что используется при определении чистоты препарата.
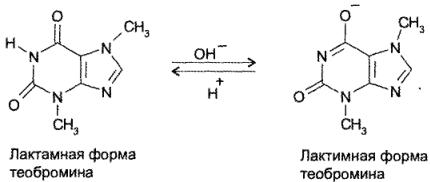
Теобромин и теофиллин являются амфотерными соединениями. Их основные свойства обусловлены наличием неподеленной пары электронов атома азота в 9-м положении. Кислотные свойства теобромина (рКа= 9,9) связаны с подвижностью атома водорода имидной группы, а теофиллина (рК,
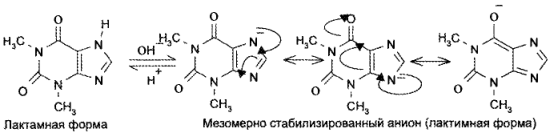
8,8) — с подвижностью атома водорода при гетероатоме азота в 7-м положении. Кислотные свойства у теофиллина выражены сильнее, чем у теобромина. Это связано с тем, что теобромин в растворах щелочей образует только лактимную форму, а теофиллин — мезомерно стабилизированный анион:
Обладая более выраженными, чем у теобромина, кислотными свойствами, теофиллин растворяется не только в щелочах, но и в растворе аммиака:
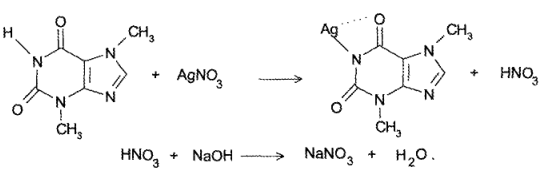
За счет кислотных свойств теофиллин и теобромин образуют растворимые соли не только со щелочами, но и с органическими основаниями. С солями тяжелых металлов (Аg + , Со 2+ , Сu 2+ ) получаются нерастворимые соединения.
Мурексидная проба (общегрупповая реакция)
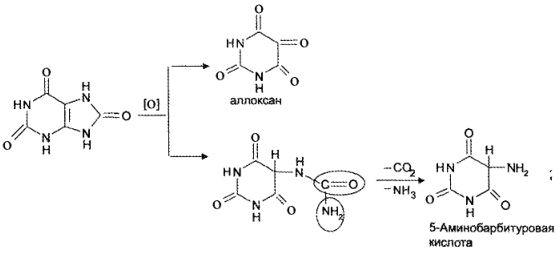
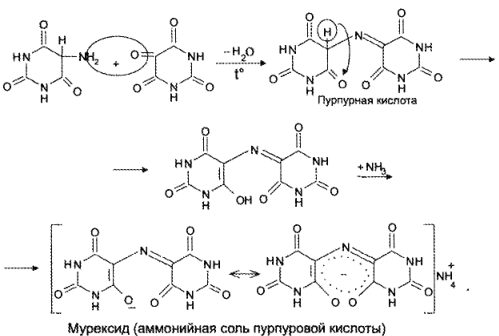
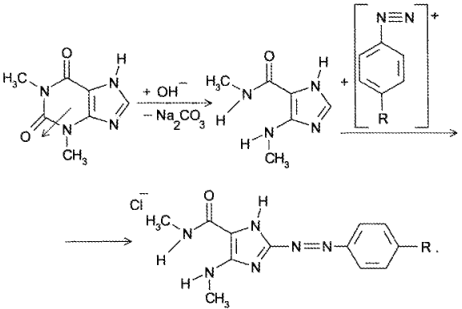
Реакция основана на окислительно-гидролитическом разложении веществ группы ксантина до производных пиримидина, в которых 1 или 2 аминогруппы конденсируются друг с другом до образования пурпурной кислоты, имеющей в виде аммонийной соли красно фиолетовое окрашивание. Для проведения реакции препарат нагревают на водяной бане до полного упаривания с окислителем (Н2О2, Вr2, НNО3) в кислой среде. Затем добавляют раствор аммиака; появляется пурпурно-красное окрашивание.
Химизм (на примере мочевой кислоты):
Для мочевой кислоты нагревание производят с кислотой азотной концентрированной, которая окислительно разлагает вещество до аллоксана и 5-аминобарбитуровой кислоты. Затем продукт окисления (как карбонильное соединение) конденсируется с продуктом гидролиза до пурпурной кислоты, которая в присутствии аммиака переходит в мезостабилизированный анион, назывемый мурексидом.
В случае метилированных производных ксантина вместо азотной кислоты применяют раствор пероксида водорода в солянокислой среде и затем добавляют аммиак (в случае, если он не образуется при гидролизе препарата).
Реакции электрофильного замещения после щелочного гидролиза
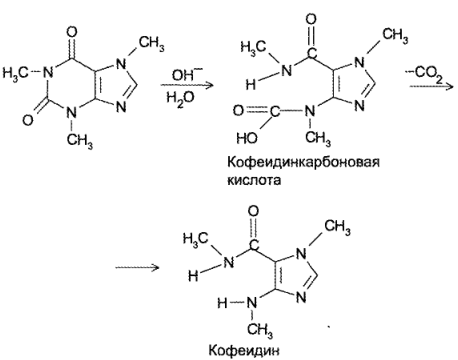
Кофеин, обладающий слабоосновными свойствами, неустойчив в щелочной среде. При pH > 9 происходит разложение кофеина до кофеидинкарбоновой кислоты, которая разлагается с образованием кофеидина и соответствующего карбоната. Причем кофеидия является антагонистом кофеина по фармакологическому действию, что может привести к нежелательным последствиям при применении разложившегося препарата.
В сернокислой среде кофеин может разложиться до муравьиной кислоты. Аналогично разлагается теофиллин до теофиллидина, который далее может быть идентифицирован по реакции азосочетания с солью диазония с образованием азокрасителя:
Другие реакции
Теофиллин образует с 2,6-дихлорхинонхлоримидом в боратном буферном растворе (pH 8,5) мероцианиновый краситель интенсивно-голубого цвета:
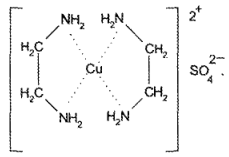
Эуфиллин реагирует с раствором сульфата меди с образованием комплексного соединения красно-фиолетового цвета (реакция на остаток этилендиамина):
Аденозинтрифосфорная кислота (и натриевая соль) за счет остатка рибозы взаимодействует с орцином в присутствии небольшого количества хлорида железа (III) с образованием продукта конденсации сине-зеленого цвета:
В азатиоприне нитро-группу восстанавливают до первичной ароматической амино-группы и далее проводят диазотирование и азосочетание с фенолом (образование азокрасителя).
Остаток бензойной кислоты в кофеин-бензоате натрия открывают качественной реакцией с хлоридом железа (III) — образуется осадок телесного цвета.
Методы количественного определения
- Кислотно-основное титрование в неводной среде. Препараты-основания и соли оснований определяют в среде уксусного ангидрида (кофеин) или смеси ледяной уксусной кислоты и уксусного ангидрида (ксантинола никотинат). Титрант — 0,1М раствор хлорной кислоты.
Обладающие кислотными центрами теобромин, теофиллин растворяют в протофильных растворителях (диметилформамид, пиридин, бутил амин) и титруют растворами метилатов натрия или калия.
- Косвенный метод нейтрализации. При взаимодействии теобромина и теофиллина с раствором нитрата серебра образуется эквивалентное препаратам количество азотной кислоты, которую титруют стандартным раствором гидроксида натрия:
- Кислотно-основное титрование в водной среде. Кофеин-бензонат натрия определяют по остатку бензоата натрия титрованием стандартным раствором хлороводородной кислоты в присутствии эфира.
Эуфиллин за счет остатка этилендиамина количественно определяют титрованием стандартным раствором хлороводородной кислоты.
- Аргентометрия (обратный способ). К раствору теофиллина или теобромина добавляют аммиак и фиксированный избыток титрованного раствора нитрата серебра; образуется нерастворимая серебряная соль. Осадок отфильтровывают и в фильтрате определяют избыток нитрата серебра титрованием со стандартным раствором роданида аммония (индикатор – железоаммониевые квасцы).
- Йодометрия. Применяется для определения кофеина в кофе- ин-бензоате натрия. Метод основан на образовании осадка перйодида кофеина в кислой среде (соff • Нl • 14), который отфильтровывают и в фильтрате определяют избыток йода.
- Метод Кьельдаля (определение азота в органических веществах).
Данным методом определяют дипрофиллин.
- Весовой метод. Метод иногда используют для определения кофеина в лекарственных формах заводского производства (кофеин извлекают из смеси в щелочной среде хлороформом; далее хлороформ отгоняют, остаток высушивают и взвешивают).
- Физико-химические методы (УФ-спектрофотометрия, ГЖХ и ВЭЖХ) применяют для количественного определения препаратов группы пурина в лекарственных формах заводского производства. Метод рефрактометрии применяют для анализа растворов кофеинбензоата натрия в условиях аптеки.
Источник
Нарушения пуринового обмена
| Сайт: | Образовательный портал МБФ (ВолгГМУ) |
| Курс: | Медицинская биохимия, принципы измерительных технологий в биохимии, патохимия, диагностика, биохимия злокачественного роста. Часть 2. |
| Книга: | Нарушения пуринового обмена |
| Напечатано:: | Гость |
| Дата: | Среда, 22 Сентябрь 2021, 17:07 |
Оглавление
1. Пуриновый обмен
Пуриновый обмен — совокупность процессов синтеза и распада пуриновых нуклеотидов. Пуриновые нуклеотиды состоят из остатка азотистого пуринового основания, углевода рибозы (дезоксирибозы), связанного бета-гликозидной связью с атомом азота пуринового основания, и одного или нескольких остатков фосфорной кислоты, присоединенных эфирной связью к атому углерода углеводного компонента.
Важнейшие азотистые основания
Мажорным пуриновым нуклеотидом является АТФ. В организме АТФ является одним из самых часто обновляемых веществ; так, у человека продолжительность жизни одной молекулы АТФ менее 1 мин. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг АТФ в день, но содержит в каждый конкретный момент примерно 250 г), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
Аденозинтрифосфа́т или Аденозинтрифосфорная кислота (сокр. АТФ, англ. АТР) — нуклеозидтрифосфат, имеющий большое значение в обмене энергии и веществ в организмах. АТФ — универсальный источник энергии для всех биохимических процессов, протекающих в живых системах. Открытие вещества произошло в 1929 году группой учёных Гарвардской медицинской школы — Карлом Ломаном, Сайрусом Фиске и Йеллапрагадой Суббарао, а в 1941 году Фриц Липман показал, что АТФ является основным переносчиком энергии в клетке.
У человека и приматов мочевая кислота — конечный продукт обмена пуринов, образующийся в результате ферментативного окисления ксантина под действием ксантиноксидазы; у остальных млекопитающих мочевая кислота превращается в аллантоин. Небольшие количества мочевой кислоты содержатся в тканях (мозг, печень, кровь), а также в моче и поте млекопитающих и человека. При некоторых нарушениях обмена веществ происходит накопление мочевой кислоты и её кислых солей (уратов) в организме (камни в почках и мочевом пузыре, подагрические отложения, гиперурикемия). У птиц, ряда пресмыкающихся и большинства наземных насекомых мочевая кислота — конечный продукт не только пуринового, но и белкового обмена. Система биосинтеза мочевой кислоты (а не мочевины, как у большинства позвоночных) в качестве механизма связывания в организме более токсичного продукта азотистого обмена — аммиака — развилась у этих животных в связи с характерным для них ограниченным водным балансом (мочевая кислота выводится из организма с минимальным количеством воды или даже в твёрдом виде). Высохшие экскременты птиц (гуано) содержат до 25 % мочевой кислоты. Обнаружена она и в ряде растений.
1.1. Синтез пуринов de Novo
Основным путем образования пуриновых нуклеотидов является синтез из простых предшественников (de novo). В этом метаболическом пути свободное азотистое основание не образуется, а пуриновое кольцо формируется на остатке рибозо-5-фосфата при участии глицина, амидного азота Глн, а-NН2-группы Асп, СО2 и одноуглеродных производных: метенил- и формил-Н4-фолата. Синтез пуриновых оснований происходит во всех клетках организма , главным образом в печени. Исключение составляют эритроциты, полиморфноядерные лейкоциты, лимфоциты.
Условно все реакции синтеза можно разделить на 4 этапа:
1. Синтез 5′-фосфорибозиламина
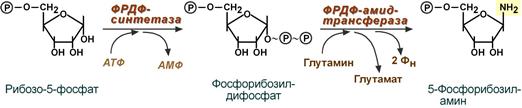
Первая реакция синтеза пуринов заключается в активации углерода в положении С 1 рибозо-5-фосфата, это достигается синтезом 5-фосфорибозил-1-дифосфата (ФРДФ). Рибозо-5-фосфат является тем якорем, на основе которого синтезируется сложный пуриновый цикл.
Вторая реакция – это перенос NH 2-группы глутамина на активированный атом С 1 рибозо-5-фосфата с образованием 5′-фосфорибозиламина . Указанная NH 2-группа фосфорибозиламина уже принадлежит будущему пуриновому кольцу и ее азот будет атомом номер 9.
Реакции синтеза 5′-фосфорибозиламина
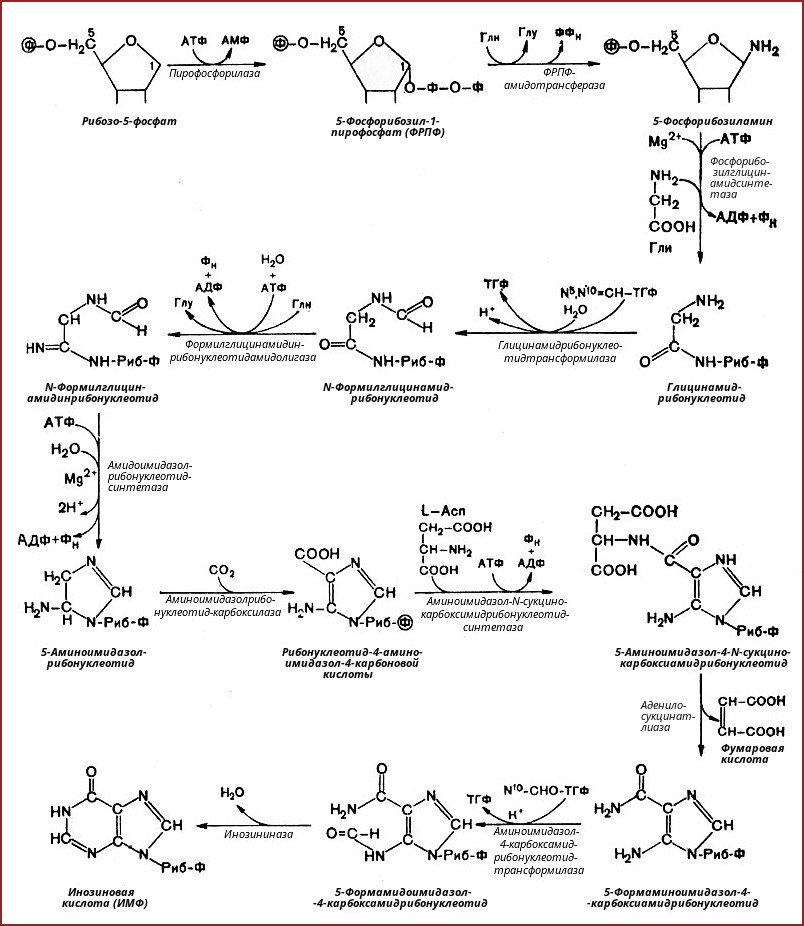
2. Синтез инозинмонофосфата
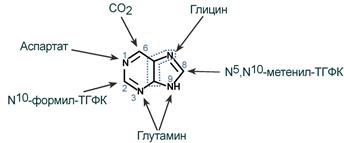
5-фосфорибозиламин вовлекается в девять реакций, и в результате образуется первый пуриновый нуклеотид – инозинмонофосфорная кислота (ИМФ). В этих реакциях источниками атомов пуринового кольца являются глицин, аспартат, еще одна молекула глутамина, углекислый газ и производные тетрагидрофолиевой кислоты (ТГФК). В целом на синтез пуринового кольца затрачивается энергия 6 молекул АТФ.
Источники атомов пуринового кольца
В схеме представлена последовательность всех 11 химических реакций этого синтеза с указанием ферментных систем, коферментов, источников энергии и других известных к настоящему времени кофакторов.
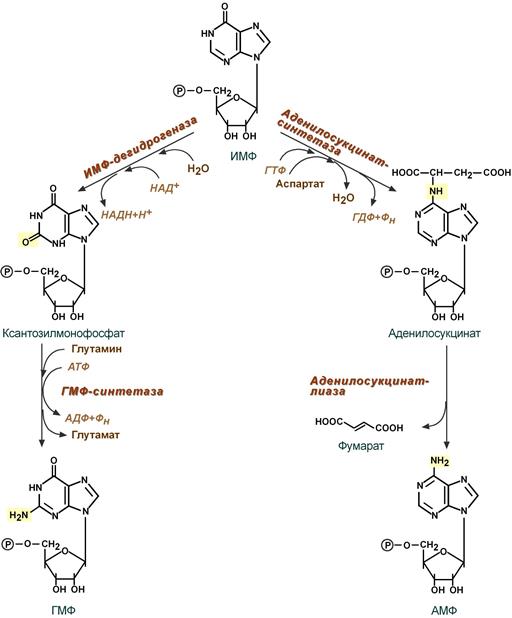
3. Синтез аденозинмонофосфата и гуанозинмонофосфата
- Гуанозинмонофосфат (ГМФ) образуется в двух реакциях – сначала он окисляется ИМФ-дегидрогеназой до ксантозилмонофосфата, источником кислорода является вода, акцептором водорода – НАД. После этого работает ГМФ-синтетаза, она использует универсальный клеточный донор NH 2-групп – глутамин, источником энергии для реакции служит АТФ.
- Аденозинмонофосфат (АМФ) также образуется в двух реакциях, но в качестве донора NH 2-группы выступает аспарагиновая кислота. В первой, аденилосукцинат-синтетазной, реакции на присоединение аспартата используется энергия распада ГТФ, во второй реакции аденилосукцинат-лиаза производит удаление части аспарагиновой кислоты в виде фумарата.
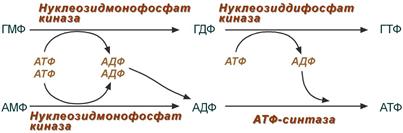
4. Образование нуклеозидтрифосфатов АТФ и ГТФ.
Синтез ГТФ осуществляется в 2 стадии посредством переноса макроэргических фосфатных групп от АТФ. Синтез АТФ происходит несколько иначе. АДФ из АМФ образуется также за счет макроэргических связей АТФ. Для синтеза же АТФ из АДФ в митохондриях есть фермент АТФ-синтаза , образующий АТФ в реакциях окислительного фосфорилирования.
Образование дезоксирибонуклеотидов
Особенностью обмена пуринов является то, что они могут образовывать не только рибонуклеотиды, но и дезоксирибонуклеотиды.
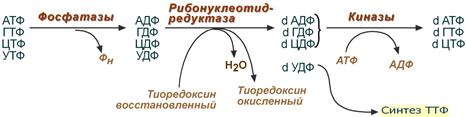
Дезоксирибонуклеозидтрифосфаты необходимы клетке для синтеза ДНК . Их образование протекает в три реакции, первая и третья реакции просты и понятны. Главные события происходят во второй реакции.
Все три реакции синтеза дезоксирибонуклеотидов
1. Реакция дефосфорилирования
В самом начале процесса происходит потеря рибонуклеозидтрифосфатами одной фосфатной группы и образуются АДФ, ГДФ, ЦДФ, УДФ.
2. Реакция восстановления
Во второй реакции фермент рибонуклеозид-редуктаза восстанавливает АДФ, ГДФ, ЦДФ, УДФ до дезоксирибонуклеозиддифосфатов dАДФ, dГДФ, dЦДФ, dУДФ. Донором водорода для восстановления рибозы является белок тиоредоксин , его SH-группы окисляются кислородом рибозы и образуется вода. Последующее восстановление тиоредоксина в рабочее состояние обеспечивается за счет НАДФН.
Механизм реакции синтеза дезоксирибонуклеотида
3. Реакция фосфорилирования
После образования dАДФ, dГДФ, dЦДФ фосфорилируются, а dУДФ используется для синтеза тимидилового нуклеотида.
Тиоредоксины
Тиоредоксины — семейство маленьких белков, представленный во всех организмах от архей до человека. Они участвуют во многих важных биологических процессах, включая определение окислительно-восстановительного потенциала клетки и передачу сигнала. У человека тиоредоксин кодируется геном TXN. Мутации, приводящие к потери функциональности даже одного аллеля этого гена, приводят к смерти на стадии четырёхклеточного эмбриона. Тиоредоксин играет значительную роль в организме человека, хотя и не до конца ясно какую именно. Всё чаще и чаще его возможные функции связывают с действием лекарств и противодействием активным формам кислорода. У растений тиоредоксины регулируют целый спектр жизненно важных функций, начиная от фотосинтеза и роста и заканчивая цветением, развитием и прорастанием семян. А совсем недавно выяснилось, что они также участвует в межклеточном взаимодействии и обмене информацией между растительными клетками
Тиоредоксины представляют собой белки с массой около 12 кДа. Их отличительная особенность — наличие двух расположенных рядом остатков остатков цистеина, заключённых в мотив типа CXXC, где С — цистеин, а Х — любая, как правило гидрофобная, аминокислота. Ещё одна отличительной черта всех тиоредоксинов — специфическая третичная структура, которая называется тиоредоксиновой укладкой.
Главной частью белка является дисульфидная связь. При помощи этой неё он может восстанавливать дисульфидные связи других белков, разрушая в них дисульфидные мостики. Таким образом он регулирует активность некоторых ферментов. Кроме того, восстанавливая дисульфидные связи, тиоредоксин поставляет электроны, которые затем используются во многих биохимических процессах клетки. Например, вместе с глутатионом он поставляет электроны для рибонуклеотидредуктазы, то есть участвует в синтезе дезоксинуктлеотидов, и ФАФС-редуктазы. В этом плане, его функция сходна с таковой у глутатиона и частично с ней перекрывается. Так, тиоредоксин является сильным антиоксидантом: вместе с глутатионовой системой тиоредоксиновая система участвует в обезвреживание активных форм кислорода, передовая электроны различным пероксидазам. Исследования показали, что тиоредоксин взаимодействует с рибонуклеазой, хориогонадотропинами, факторами коагуляции, глюкокортикоидным рецептором и инсулином. Реакцию тиоредоксина с инсулином традиционно используют для определения активности тиоредоксина. Было показано, что тиоредоксин способен стимулировать связывание факторов транскрипции с ДНК. Эти факторы были определены как ядерный фактор NF-κB, который является важным фактором в клеточной реакции на окислительный стресс, апоптоз и процессы опухолеобразования.
Восстановление тиоредоксина осуществляет специальный флавопротеин тиоредоксин редуктаза, который использует для этого одну молекулу НАДФН. Глутаредоксины во многом сходны по функциям с тиоредоксинами, но вместо специфической редуктазы они восстанавливаются глутатионом.
 | ↔ 2 H + + 2 e — + |  |
| Восстановленный тиоредоксин | Окисленный тиоредоксин |
Способность тиоредоксинов противостоять окислительному стрессу была продемонстрирована в эксперименте с трансгенными мышами у которых была повышенная экспрессия тиоредоксина. Трансгенные мыши лучше сопротивлялись воспалительным реакциям и жили на 35 % дольше. Такие данные служат существенным аргументом в пользу свободнорадикальной теории старения. Тем не менее, результаты исследования нельзя считать достоверными, поскольку контрольная группа мышей жила значительно меньше обычного, что могло создать иллюзию увеличения продолжительности жизни у трансгенных мышей [9] .
У растений существует очень сложная система тиоредоксинов, состоящая из шести хорошо различимых типов (тиоредоксины f, m, x, y, h, и o). Они расположены в разных частях клетки и участвуют в массе различных процессов. Именно действие тиоредоксинов лежит в основе светозависимой активации ферментов. На свету, в результате совместного действия фотосистемы I и фотосистемы II образуется большое количество восстановительных эквивалентов — ферредоксинов. По достижении определённой концентрации ферредоксина, за счёт действия Фермент ферредоксин-тиоредоксинредуктазы происходит восстановление тиоредоксина, который в свою очередь активирует ферменты, восстанавливая дисульфидные связи. Таким путём активируется по крайней мере пять ключевых ферментов цикла Кальвина, а также белок-активаза Рубиско, альтернативная оксидаза митохондрий и терминальная оксидаза хлоропластов. Механизм активации через тиоредоксин позволяет регулировать активность ферментов не только в зависимости от соотношения НАДФН/НАДФ + , но и одновременно от интенсивности света. В 2010 году была открыта необычная способность тиоредоксинов перемещаться из клетки в клетку. Такая способность лежит в основе нового, ранее не известного для растений, способа межклеточной коммуникации
1.2. Переваривание нуклеиновых кислот и резервные источники пуриновых оснований
«Запасные» пути синтеза пуриновых нуклеотидов (реутилизация азотистых оснований и нуклеозидов)
Огромные затраты энергии для синтеза пуриновых нуклеотидов de novo не способны полностью обеспечить субстратами синтез нуклеиновых кислот в период гаструляции и раннего роста ребёнка. Потребность в большом количестве нуклеотидов привела к развитию «запасных» путей синтеза этих «дорогих» молекул. Наибольшее значение в этом процессе имеют ферменты, осуществляющие превращение пуринов в мононуклеотиды с использованием ФРДФ как донора остатка фосфорибозы.
Синтез АМФ и ГМФ из аденина и гуанина
ФРДФ-зависимое фосфорибозилирование пуринов катализируют 2 фермента.
- Аденинфосфорибозилтрансфераза (APRT), ответственная за образование АМФ (рис. 10-6).
- Гипоксантин-гуанинфосфорибозилтрансфераза (HGPRT), катализирующая образование ИМФ и ГМФ из гипоксантина и гуанина соответственно.
Однако в организме при любых ситуациях этот путь синтеза пуриновых нуклеотидов, получивший название «Salvage pathways», имеет вспомогательное значение.
Нуклеозидкиназы
Нуклеозиды, получающиеся при катаболизме нуклеиновых кислот из нуклеотидов под действием нуклеотидаз, могут повторно фосфорилироваться, образуя нуклеозид-5′-монофосфаты за счёт переноса γ-фосфатного остатка АТФ на соответствующий субстрат. У млекопитающих такой путь пополнения запасов пуриновых нуклеотидов в клетке не имеет существенного значения. Основным ферментом этой группы является аденозинкиназа, которая ускоряет реакцию:
Аденозин + АТФ → АМФ + АДФ.
Из всех способов реутилизации пуринов наиболее активна гипоксантин-гуанинфосфорибозилтрансферазная реакция, поскольку ИМФ, образующийся в этой реакции, вовлекается в синтез АМФ и ГМФ. Использование гипоксантина и гуанина по запасному пути становится жизненно важным событием в клетках, не способных к синтезу пуриновых нуклеотидов de novo. Значение аденинфосфорибозилтрансферазы в повторном использовании аденина менее существенно. По сравнению с аденозином количество аденина в клетках мало, а первый возвращается в фонд нуклеотидов с помощью аденозинкиназы.
Рис. Фосфорибозилирование аденина в АМФ.
Рис. Фосфорибозилирование гипоксантина и гуанина с образованием ИМФ и ГМФ
Синтез AMP из IMP и сохранение IMP через катаболизм AMP имеют чистый эффект дезаминирования аспартата на фумарат. Этот процесс был назван пуриновым нуклеотидным циклом (см. Диаграмму ниже). Этот цикл очень важен в мышечных клетках. Увеличение активности мышц создает потребность в увеличении цикла TCA, чтобы генерировать больше NADH для производства ATP. Однако у мускула не хватает большинства ферментов основных анаплевротических реакций. Мышцы пополняют промежуточные продукты цикла TCA в форме фумарата, продуцируемого пуриновым нуклеотидным циклом.

Пуриновый нуклеотидный цикл служит важной функцией при тренировке мышц. Генерация фумарата обеспечивает скелетную мышцу своим единственным источником анаплеротического субстрата для цикла TCA. Для продолжения работы цикла во время тренировки мышечный белок должен быть использован для доставки аминокислот для образования аспартата. Генерация аспартата происходит по стандартным реакциям трансаминации, которые взаимопревращают аминокислоты с α-кетоглутаратом с образованием глутамата и глутамата с оксалацетатом с образованием аспартата. Myoadenylate deaminase — это мускуло-специфическая изоформа АМФ-дезаминазы, а недостатки в myoadenylate deaminase приводят к усталости после тренировки, судорогам и миалгии.
1.3. Регуляция пуринового обмена
Следует отдельно подчеркнуть существование в клетках весьма тонкого механизма регуляции синтеза пуриновых нуклеотидов . Синтез их тормозится конечными продуктами по принципу обратной связи, т.е. ингибированием первой стадии переноса аминогруппы глутамина на ФРПФ. Фермент , катализирующий эту стадию, оказался аллостерическим регуляторным ферментом . Вторая особенность механизма регуляции заключается в том, что избыток ГМФ в клетках оказывает аллостерическое торможение только на свой собственный синтез, не влияя на синтез АМФ , и, наоборот, накопление АМФ подавляет свой синтез, не ингибируя синтеза ГМФ.
2. Нарушения пуринового обмена
К наиболее важным нарушениям пуринового обмена относятся избыточное образование и накопление мочевой кислоты, например при подагре и синдроме Леша — Найхана. В основе последнего лежит наследственная недостаточность фермента гипоксантинфосфатидилтрансферазы, вследствие чего свободные пурины не используются повторно, а окисляются в мочевую кислоту.
Клинические проблемы, связанные с метаболизмом нуклеотидов у людей, в основном являются результатом аномального катаболизма пуринов. Клинические последствия аномального метаболизма пуринов варьируются от умеренных до тяжелых и даже фатальных расстройств. Клинические проявления аномального катаболизма пуринов возникают из-за нерастворимости побочного продукта деградации, мочевой кислоты. Подагра является условием, которое возникает в результате осаждения урата в виде кристаллов мононатриевого урата (MSU) или дигидрата пирофосфата кальция (CPPD) в синовиальной жидкости суставов, что приводит к сильному воспалению и артриту. Воспалительный ответ связан с наличием кристаллов, вовлеченных в каспазу-1-активирующее воспаление, что приводит к получению интерлейкина-1β (IL-1β) и IL-18. Большинство форм подагры являются результатом избыточного производства пуринов и последующего катаболизма или частичного дефицита фермента спасения, HGPRT. Большинство форм подагры можно лечить, вводя антиметаболит: аллопуринол. Это соединение является структурным аналогом гипоксантина, который сильно ингибирует ксантиноксидазу.
Два серьезных нарушения, оба достаточно хорошо описаны, связаны с недостатками в пуриновом обмене: синдром Леша-Нихана и тяжелое комбинированное иммунодефицитное заболевание (SCID). Синдром Леша-Нихана является результатом потери функционального гена HGPRT. Расстройство наследуется как связанная с полом черта с геном HGPRT на Х-хромосоме (Xq26-q27.2). Пациенты с этим дефектом проявляют не только тяжелые симптомы подагры, но также серьезную неисправность нервной системы. В наиболее серьезных случаях пациенты прибегают к саморазрушению. Смерть обычно возникает прежде, чем пациенты достигнут двадцатилетия.
SCID относится к группе потенциально смертельных расстройств из-за комбинированной потери функции как T-, так и B-лимфоцитов. Существует, по меньшей мере, 13 известных и охарактеризованных генетических причин SCID. Наиболее распространенной (45%) причиной SCID является Х-связанное расстройство, вызванное потерей функции общей гамма-γ-цепи рецептора Т-клеток и других рецепторов интерлейкина (IL). Вторая наиболее распространенная (15%) форма SCID вызвана дефектами фермента аденозиндезаминазы, ADA. Это фермент, ответственный за превращение аденозина в инозин в катаболизме пуринов. Этот дефицит избирательно приводит к разрушению B и T лимфоцитов, клеток, которые создают иммунные ответы. В отсутствие ADA дезоксиаденозин фосфорилируется с образованием уровней dATP, которые в 50 раз выше, чем обычно. Уровни особенно высоки в лимфоцитах, которые имеют обильное количество спасительных ферментов, включая нуклеозид-киназы. Высокие концентрации dATP ингибируют рибонуклеотидредуктазу (см. Ниже), тем самым предотвращая образование других dNTP. Чистым эффектом является ингибирование синтеза ДНК. Поскольку лимфоциты должны быть способны резко размножаться в ответ на антигенный вызов, невозможность синтезировать ДНК серьезно ухудшает иммунные реакции и болезнь. Накопительный dATP также индуцирует разрывы ДНК-цепей в не делящихся лимфоцитах посредством прямой активации основной протеазы ( каспаза 9), участвующих в апоптозе (запрограммированная гибель клеток). Кроме того, активность S-аденозиломоцистеинагидролазы заметно ингибируется 2′-дезоксиаденозином, что приводит к накоплению S-аденозилгомоцистеина, что, в свою очередь, приводит к уменьшению синтеза S-аденозилметионина (AdoMet), критического субстрата в реакциях трансметилирования. ADID с дефицитом SCID обычно смертелен в младенчестве, если не приняты специальные защитные меры. Менее тяжелый иммунодефицит возникает при отсутствии активности пуриновой нуклеозидфосфорилазы (PNP), другого фермента, разрушающего пурин.
Одна из многих заболеваний, связанных с сохранением гликогена, болезнь Гирке также приводит к чрезмерному производству мочевой кислоты. Это расстройство является следствием дефицита глюкозо-6-фосфатазной активности. Повышенная доступность глюкозо-6-фосфата увеличивает скорость потока через пентозо-фосфатный путь, что приводит к повышению уровня рибозо-5-фосфата и, следовательно, ФРДФ. Увеличение ФРДФ приводит к избыточному биосинтезу пуринов с последующим катаболизмом к мочевой кислоте.
Источник