Электронный учебник
Содержание
Глава 5. Лекарственные средства для парентерального применения
5.11. Методы контроля качества инъекционных растворов
Определение норм наполнения. Фактический объем наполнения сосудов должен быть больше номинального, чтобы обеспечить нужную дозу при наполнении шприца. Государственная фармакопея (ГФ) – фармакопея, находящаяся под государственным надзором. ГФ является документом общегосударственной законодательной силы, его требования обязательны для всех организаций данного государства, занимающихся изготовлением, хранением и применением лекарственных средств, в том числе растительного происхождения»>ГФ ХI издания устанавливает нормы налива и количества сосудов для контроля. В сосудах вместимостью до 50 мл наполнение проверяют калиброванным шприцем, в сосудах вместимостью 50 мл и более – калиброванным цилиндром при температуре 20±2°С. Таблица норм наполнения ампул растворами приведена выше.
Определение герметичности. Контроль качества запайки или укупорки проходят 100% сосудов и для определения герметичности используют 3 метода:
- Вакуумирование – обработка образца (жидкости или твердого тела), при которой его нагревают в вакууме, чтобы изъять адсорбируемый или растворенный газ»>вакуумирование;
- с помощью растворов индикаторов (для водных растворов) и воды или мыльного раствора (для масляных растворов);
- по свечению газовой среды внутри сосуда под действием высокочастотного электрического поля.
Контроль на механические включения. Проводят путем просмотра сосудов на черном и белом фоне при освещении 60 Вт. На черном фоне проверяются прозрачность и наличие механических включений – стеклянная пыль, волокна фильтрующих материалов, не растворенные частицы лекарственного вещества и т.д.; на белом – цветность раствора, отсутствие механических включений черного цвета и целостность стеклянного изделия. Метод имеет недостатки: субъективизм контролируемого – острота зрения, опыт работы, усталость контролера и т.д. Допустимая ошибка метода составляет 30%.
Для более объективной оценки качества раствора по этому параметру были разработаны другие методы (фото 
- изуально-оптические, основанные на использовании проекторов, увеличительных линз, поляризационного света и т.д.;
- оптические, с автоматической регистрацией фотоэлементами поглощения или рассеивания проходящего света;
- мембрано-микроскопические;
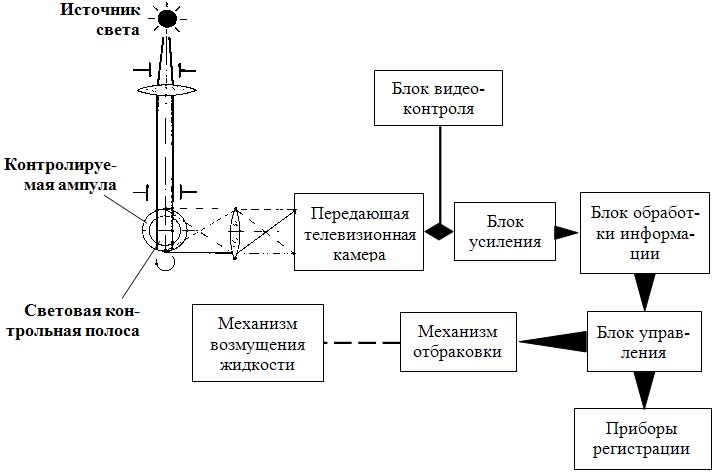
- проточные методы (рис. 5.26).
Рис. 5.26. Устройство установки для объективного контроля чистоты раствора в ампулах (схема)
Препараты, анализируемые биологическим методом, должны содержать активные ингредиенты в пределах, указанных в соответствующей НТД.
Источник
Анализ инъекционных лекарственных средств
Оказание услуг бесплатной скорой и неотложной медицинской помощи является наиболее острой проблемой экстренной медицины, которая остается нерешенной до настоящего времени. Как было выявлено в ранее проведенных исследованиях [1; 4], объективными причинами предоставления некачественных услуг скорой помощи являются недостаточное финансирование по всем видам медицинской помощи, отсутствие необходимого оборудования и др. При этом особое внимание обращает на себя несоответствие медикаментозной помощи, оказанной врачами и фельдшерами на этапе первичного обращения пациента во врачебную амбулаторию, фельдшерско-акушерский пункт (ФАП) или бригадой скорой медицинской помощи (СМП) на месте и в пути, необходимому объему медицинской помощи и консервативному лечению в условиях стационара (ЦРБ), соответствующему тяжести состояния пациента и опасности возникающих осложнений [6; 7].
Целью исследования явилось изучение структуры потребления лекарственных препаратов на различных этапах оказания скорой медицинской помощи при угрожающих состояниях на примере медицинских организаций Республики Адыгея.
Объектом исследования служила ГБУЗ «Центральная районная больница Гиагинского района», в структуру которой входят 2 врачебные амбулатории, 9 ФАП, подразделение (отделение) скорой медицинской помощи (санавиация), состоящее из двух бригад СМП (фельдшерской и врачебной) и стационарных отделений центральной районной больницы, имеющих специализацию по реанимации, педиатрии, терапии, хирургии, инфекционному делу и неврологии.
Как показали результаты наших исследований [5], при формировании необходимого ассортимента лекарственных препаратов (ЛП), персонал врачебных амбулаторий и ФАП руководствуется сложившимися на практике правилами о наличии укладок ЛП для оказания помощи при экстренных и неотложных состояниях. Наряду с этим перечень ЛП, используемый в стационарном отделении, регламентируется, в первую очередь, Программой государственных гарантий оказания медицинской помощи гражданам РФ, специализацией отделения, проводимыми медицинскими манипуляциями, а также особенностями сочетанной терапии сопутствующих заболеваний. Поэтому особый интерес представляет преемственность лекарственной терапии на всех трех этапах оказания медицинской помощи [3; 5].
Исследование выполнено по 145 наименованиям МНН ЛП, в различных лекарственных формах, применение которых было установлено по 1973 картам пациентов, получавших в течение 2013 года медицинскую помощь на этапе ФАП и/или СМП, а затем в стационарных отделениях ЦРБ.
При ранжировании показателей по частоте применения ЛП на этапах СМП — ФАП — стационар ЦРБ получились следующие результаты:
— во-первых, на этапе СМП по частоте применения используемых фармакологических групп преобладают сиптоматические ЛП, в большей степени подавляющие симптомы заболеваний и не влияющие на патогенез и его дальнейшее развитие: миотропные спазмолитики — 26,4%, НПВП — 16,3%, антигистаминные средства — 13,9%, растворы, влияющие на водно-электролитный баланс — 9,2%, антигипертензивные средства — 7,2%, седативные средства — 4%, бронхолитики — 3,7%, гормональные средства — 3,3%, диуретики — 3,3%, средства для коррекции метаболических процессов — 2,6%, средства, влияющие на свертывание крови — 2,1%, антиаритмические препараты — 2%, нейролептики — 1,7%, сердечные гликозиды — 1,1%. Остальные ЛП (адреномиметики, нитраты, антихолинэстеразные, местные анестетики, антигипоксанты и ноотропы, противорвортные и прочие средства) применялись в единичных случаях [2];
— во-вторых, результаты анализа частоты использования ЛП при стационарном лечении пациентов, которым ранее была оказана помощь специалистами СМП и впоследствии госпитализированных в стационар, показали, что приоритетными в назначениях врачей были ЛП, относящиеся в препаратам патогенетической терапии: кровезаменители и противошоковые — 23,9%, гормональные противовоспалительные — 12,1%, антигипертензивные — 12%, витаминные — 9,7%, антигистаминные — 9,2%, улучшающие мозговое кровообращение — 8,9%, противоаритмические — 6,5%, наркотические анальгетики — 5,7%, бронхолитики — 5,3%, транквилизаторы — 3,1%.
В дальнейшем была проведена детализация расхода 74 ЛП, наиболее часто используемых на всех этапах оказания помощи по международному непатентованному наименованию (МНН), лекарственной форме и количеству применений (таблица 1).
Таблица 1 — Частота применения лекарственных препаратов на различных этапах оказания медицинской помощи населению, ед.
Торговое наименование ЛП
калия магния аспарагинат
ментола раствор в изовалерате
Как следует из таблицы 1, только 12 наименований ЛП (атропина сульфат, метамизол, гепарин, глицин, дроперидол, клонидин, кофеин-бензоат натрия, фенилэфрин, прокаинамид, водорода перекись, уголь активированный, аминофиллин), что составило 16,2%, применяются в стационаре в тех же объемах, частоте и показаниях, что и на этапе СМП. Обращает на себя внимание факт, неоднократно ранее отмеченный авторами данной работы [1; 2; 4], а также другими исследователями [3; 6], указывающий на приоритетное использование более дешевых лекарственных препаратов гепарина отечественного производства по сравнению с импортными аналогами более эффективного фракционированного низкомолекулярного гепарина (фраксипарин, клексан).
Выявлено, что 14 наименований ЛП (23%) гораздо чаще применялись на этапе СМП, чем в стационаре, в том числе: в 1,5-2 раза — 6 наименований (коргликон, платифиллин, семакс, хлоропирамин, активированный уголь, бриллиантовый зеленый), в 2,5-4 раза — 4 наименования (эпинефрин, аммиак, дибазол, ацетилсалициловая кислота), более чем в 5 раз — 7 ЛП (тиамин, метамизол+питофенон, парацетамол в форме сиропа для детей, нитроглицерин в аэрозоли, метопролол, ментола раствор, димеркаптопропансульфонат).
В свою очередь, 42 лекарственных препарата (56,8%) у тех же пациентов в стационаре применялись чаще, чем бригадами СМП: в 1,5-2 раза — 21 ЛП (аскорбиновая кислота, верапамила гидрохлорид, дексаметазон, дигоксин, диклофенак натрия, дифенгидрамин, допамин, дротаверин, йод, каптоприл, кеторолак натрия, этилброизовалерианат, магния сульфат, натрия хлорид, нифедипин, папаверина гидрохлорид, диазепам, этанол, сульфокамфокаин, метоклопрамид, этамзилат). Данный перечень, включающий основные ЛП, применяемые как симптоматические, коррелирует с результатами предыдущих исследований, проведенных авторами в 2012 году [2]. Еще чаще — в 2,5-4 раза в стационаре применялись 8 ЛП (аминокапроновая кислота, ацетилсалициловая кислота в высоких дозах, морфина гидрохлорид, декстроза, лидокаин, этилметилгидроксипиридина сукцинат, трамадол, сальбутамол, фуросемид), и более чем в 5 раз — 12 ЛП (хлорпромазин, калия-магния аспарагинат, декстран, амиодарон, прокаин, пантенол, парацетамол, тримепиридин, фентанил, эналаприл), с преобладающим действием на патогенетические звенья заболеваний, что подтверждает недостаточный уровень преемственности на этапе СМП — стационар.
Среди ЛП, не применявшихся на этапе СМП, следует отметить викасол, неиспользование которого персонал поясняет отсутствием мобильной возможности контролировать показатели свертываемости крови.
Дальнейшее детальное сопоставление объемов лекарственной терапии на этапе ФАП — СМП — стационар выявило еще большее несоответствие в назначениях ЛП. Установлено, что существенная часть ЛП, применяемых на этапе СМП и в стационаре, зачастую либо отсутствовали в ФАП, либо имелись, но не применялись при имеющихся показаниях: аминокапроновая кислота, ипратропия бромид, метопролол, клонидин, амиодарон, морфина гидрохлорид, пантенол, парацетамол для инъекций, платифиллина гидротартрат, тимепиридина гидрохлорид, сальбутамол, нипагин, диазепам, трамадол, димеркаптопропансульфонат, фентанил, эналаприл для инъекций — всего 17 ЛП (22,9%).
Данный недостаток может быть обусловлен как объективными причинами — применение наркотических анальгетиков (морфин, трамадол, фентанил), бензодиазепиновых транквилизаторов (диазепам) и клонидина для инъекций в ФАП законодательно не предусмотрено ввиду отсутствия лицензии на оборот НС и ПВ, так и субъективными: замена инъекционных препаратов (парацетамол, метопролол, эналаприл) на пероральные, имеющиеся на руках у больных; применение сотрудниками бригад СМП [6] специфических препаратов, таких как димеркаптопропансульфонат (унитиол) в неспецифической антидотной терапии острых алкогольных отравлений. В свою очередь, применение таких высокоэффективных ЛП, как эналаприл (энап) для инъекций требует постоянного мониторирования и наблюдения за больным. В условиях ФАП это объясняет опасения среднего персонала при выборе антигипертензивных средств и решения в пользу менее «опасных» своими побочными действиями папаверина гидрохлорида, дибазола и аминофиллина.
Также следует обратить внимание на группу ЛП, частота применения которых в ФАП пациентам, впоследствии госпитализированным в стационар, в 5 и более раз ниже, чем в СМП и стационаре: пропранолол в таблетках, викасол, декстран, декстроза, глицин, дигоксин, допамин, каптоприл, коргликон, этилметилгидроксипиридина сукцинат, нитроглицерин в аэрозоли, нифедипин, прокаинамид, тиамина хлорид, метоклопрамид, этамзилат (всего 16 наименований — 21,6% от общего числа ЛП). Все они относятся к препаратам патогенетической терапии, действующим не на симптомы, а непосредственно на патологические процессы, что еще более доказывает отсутствие эффективной преемственности лекарственной терапии.
В разрезе лекарственных форм наибольшую преемственность имеют пероральные лекарственные формы — 90% наименований, ЛП для инъекций — 66,7%.
По результатам анализа использования ЛП на различных этапах медицинской помощи сделаны следующие выводы.
1. Только 16% ЛП, применяемых бригадами СМП, совпадает по интенсивности и объемам применения с уровнем оказания лекарственной помощи в условиях стационара.
2. Более половины (56%) ЛП, применяемых в условиях стационара, используются в недостаточном объеме на догоспитальном этапе оказания СМП пациентам, имеющим показания к применению, что снижает эффективность лечения.
3. Около 23% ЛП не применяется в необходимых объемах на этапах первичной медицинской помощи в ФАПах, что существенно изменяет результаты лечения в сторону купирования симптомов заболеваний в ущерб патогенетической терапии.
4. Формирование ассортимента ЛП на этапах ФАП — СМП — стационар необходимо проводить с учетом максимальной преемственности оказания догоспитальной экстренной помощи стационарному лечению больного.
Погорелый В.Е., д.б.н., профессор, профессор кафедры фармакологии Пятигорского медико-фармацевтического института — филиала ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России, г. Пятигорск.
Черников М.В., д.м.н., заведующий кафедрой биологии и физиологии Пятигорского медико-фармацевтического института — филиала ГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России, г. Пятигорск.
Источник
Общие методы анализа качества лекарственных средств
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Глава 1. Общие методы и приемы анализа качества лекарственных средств
Все химические вещества, применяемые как лекарственные средства (ЛС), должны отвечать требованиям Государственной фармакопеи (ГФ) по внешнему виду (раздел «Описание»), растворимости (раздел «Растворимость»), химическому составу (раздел «Испытания на подлинность»), чистоте (раздел «Испытания на чистоту»), а также по таким показателям качества, как величина pH, удельный показатель поглощения, удельное вращение, температура плавления и др. Количественное содержание действующего вещества (нескольких веществ) должно находиться в пределах, указанных в разделе «Количественное определение».
I. Определение подлинности лекарственных средств
Для установления подлинности ЛС в ГФ используется комплекс испытаний: характеристика внешнего вида, растворимость, температура плавления, температурные пределы перегонки, удельное вращение или угол вращения, значение величины pH, удельный показатель поглощения и другие показатели в ультрафиолетовой (УФ) или видимой области спектра, химические реакции на катионы, анионы или функциональные группы и др.
В настоящее время с целью совершенствования способов идентификации вводятся современные физические и физико-химические методы— такие, как инфракрасная (ИК)-спектроскопия, спектроскопия ядерно-магнитного (ЯМР) и протонного магнитного резонанса. Применение этих методов требует использования стандартных образцов лекарственных веществ.
Характеристика внешнего вида
В частной статье на каждое лекарственное вещество в разделе «Описание» в ГФ дается характеристика главным образом физических свойств (агрегатное состояние, цвет, запах). Указывается, является данное лекарственное вещество аморфным или кристаллическим порошком, характеризуются размеры кристаллов и их форма (игольчатые, кубические и др.). Иногда приводятся дополнительные сведения (тяжелый, рыхлый, легкий порошок и др.).
Агрегатное состояние лекарства имеет большое значение для характеристики его качества; известна взаимосвязь степени дисперсности кристаллов с химической и фармакологической активностью лекарственных веществ.
В зависимости от условий технологического процесса форма кристаллов одного и того же лекарственного вещества может быть различной.
Важным показателем подлинности и чистоты лекарственных веществ является их цвет. Цвет порошков определяется визуально; для объективной оценки цвета в настоящее время применяется метод отражательной спектрофотометрии, позволяющий использовать оптические свойства порошкообразных веществ.
В ГФ включена общая фармакопейная статья (ФС) «Определение степени белизны порошкообразных лекарственных средств». Степень белизны оценивается инструментальным методом на основе спектральной характеристики света, отраженного от образца лекарственного вещества. На специальных приборах измеряют коэффициент отражения (отношение величины отраженного к величине падающего на вещество светового потока).
Характеризуя цвет лекарственного вещества, ГФ иногда указывает на возможность его изменения. Так, резорцин описывается как белый или белый со слегка желтоватым оттенком порошок, который под влиянием света и воздуха постепенно приобретает розовый цвет. Таким образом, обращается внимание на нестабильность и возможность изменения химической структуры вещества под влиянием факторов окружающей среды, влекущих за собой изменение его внешнего вида. В данном случае изменение цвета является следствием легкого окисления двухатомного фенола.
Внешний вид лекарственных веществ может изменяться под влиянием различных факторов окружающей среды (света, влаги, пониженной и повышенной температуры, кислорода, воздействие диоксида углерода и других газов, сухого воздуха, пыли), что выражается в увлажнении, изменении цвета, выпадении осадков из растворов и др. При этом могут проходить химические реакции различных типов (окисление, восстановление, осаждение, гидролиз).
В связи с этим в разделе «Описание» указывается на возможность изменения лекарственных веществ при хранении. Так, отмечается, что натрия йодид на воздухе сыреет и разлагается с выделением йода. Некоторые кристаллогидраты (меди сульфат, натрия тетраборат-, магния сульфат и др.) выветриваются на воздухе (теряют часть кристаллизационной воды), что обусловливает появление белых вкраплений наряду с бесцветными (натрия тетраборат, магния сульфат) и синими (меди сульфат) кристаллами.
Выветривание кристаллизационной воды может привести к нарушению дозировки (увеличению количества основного вещества в навеске) ЛС, в том числе сильнодействующих и ядовитых.
Для правильного вывода о соответствии внешнего вида лекарственного вещества требованиям Г’Ф важно уметь связать изменения внешнего вида с химическими, которые могут произойти под влиянием факторов окружающей среды. Провизор должен обеспечить правильное хранение ЛС, для каждого из которых установлены режим (в прохладном или темном месте и др.) и сроки хранения.
Растворимость
Для обозначения растворимости лекарственных веществ в ГФ приняты условные термины («очень легко растворим», «растворим», практически нерастворим» и др.), которые определяют соотношение объема растворителя к одной весовой части лекарственного вещества. Так, для сульфацил-натрия растворимость обозначается термином «легко растворим в воде», что означает растворимость 1 г лекарственного вещества в воде объемом от 1 до 10 мл.
Для характеристики растворимости некоторых лекарственных веществ ГФ приводит соотношения веществ и растворителя (например, для натрия хлорида: растворим в 3 частях воды).
ГФ характеризует растворимость ЛС, как правило, в воде, а также в ряде растворителей (чаще – в 95% спирте, хлороформе, эфире, реже – в кислотах и щелочах). Растворимость и в кислотах, и в щелочах характерна для таких амфотерных соединений, как цинка оксид, большинство сульфаниламидов, кислота глутаминовая, таким образом, этот показатель является одним из характерных для них.
Изменение растворимости лекарственного вещества указывает на присутствие или появление в процессе хранения менее растворимых примесей и, таким образом, характеризует изменение его качества. Так, в теофиллине, хорошо растворимом в растворе аммиака, примесь сопутствующих пуриновых алкалоидов можно обнаружить по неполному растворению ЛС в растворе аммиака, поскольку остальные пуриновые алкалоиды не растворяются в этом реактиве.
У некоторых лекарственных веществ растворимость изменяется под влиянием факторов окружающей среды. Например, растворы натриевых солей барбитуратов под действием углекислого газа выделяют осадок нерастворимой в воде кислотной формы.
Определение подлинности химическими реакциями
В нормативных документах (НД) приводится сочетание групповых и специфических химических реакций для идентификации лекарственных веществ. Так, реакция диазотирования и образования азокрасителя является групповой на первичные ароматические амины и доказывает принадлежность лекарственного вещества к этом группе. Хроматическую аминогруппу содержат сульфаниламиды, производные п-аминобензойной, п-аминосалициловой кислот и др. Групповой является мурексидная реакция на пуриновые алкалоиды, идентификацию же отдельных алкалоидов этой группы проводят с помощью специфических реакций. Сочетание групповых и специфических реакций, характерных для каждого ЛС, наряду с учетом всех физических и химических свойств позволяет надежно идентифицировать ЛС.
Большое количество лекарственных веществ содержат один и тот же ион или одну и ту же функциональную группу. Эго позволило создать унифицированные методики для их идентификации с помощью химических реакций на ионы или функциональные группы и объединить в ФС «Общие реакции на подлинность».
Амины ароматические первичные. Для лекарственных веществ, содержащих первичную ароматическую аминогруппу, характерна реакция диазотирования и азосочетания, в результате которой образуется азокраситель (химизм и методики – см. тему II).
Аммонии. При нагревании растворов солей аммония с растворами щелочей выделяется аммиак, который может быть обнаружен по характерному запаху и посинению влажной красной лакмусовой бумаги:
Ацетаты. Ацетаты определяют по реакции образования сложного эфира – этилацетата, имеющего характерный запах свежих яблок:
В условиях проведения реакции обнаруживаются ацетат-ион и ацетильный радикал в органических соединениях.
Другое испытание на ацетат-ион, включенное в ГФ, — взаимодействие с железа (III) хлоридом. При добавлении к нейтральному раствору, содержащему ацетат-ион, раствора железа (III) хлорида появляется красно-бурое окрашивание из-за образования железа (III) ацетата или гидроксиацетата (последний образуется на 1-й ступени гидролиза средней соли):
При кипячении полученного раствора выпадает хлопьевидный осадок из-за углубления гидролиза, на 2-й ступени становящегося необратимым:
Бензоаты. Нейтральные растворы бензоатов с железа (III) хлоридом образуют осадок розовато-желтого цвета, растворимый в эфире:
Полученное окрашенное соединение разрушается при действии растворов кислот и щелочей.
Бромиды. Бромиды идентифицируют по реакции выделения брома в результате окислительно-восстановительной реакции между бромидом и хлорамином в кислой среде. Выделяющийся в результате реакции молекулярный бром извлекают хлороформом. Хлороформный слой окрашивается при этом в желто-бурый цвет:
Растворы бромидов с раствором серебра нитрата образуют желтоватый творожистый осадок серебра нитрата, нерастворимый в кислоте азотной и трудно растворимый в растворе аммиака (химизм
Висмут. Растворы солей висмута, подкисленные кислотой хлороводородном, образуют коричневато-черный осадок с сульфидами (химизм – см. тему 4).
Железо (11). Растворы солей железа (II) с гексацианоферрат(Ш)- ионом образуют синий осадок гекеацианоферрата (III) железа (II), возможно также образование
Осадок нерастворим в минеральных кислотах; разрушается при действии щелочей с образованием железа (II) гидроксида (химизм — см. тему 4).
Железо (1Н). Растворы солей железа (Ш)образуют с раствором гекеацианоферрата (II) калия синий осадок берлинской лазури:
При реакции с тиоцианатами растворы солей железа (III) образуются продукты красного цвета:
С растворимыми сульфидами в нейтральной или слабощелочной среде соли железа (III) дают черный осадок:
Осадок железа (III) сульфида растворяется в минеральных кислотах.
Йодиды. Йодиды являются выраженными восстановителями, поэтому слабые окислители выделяют молекулярный йод из йодидов. Йод окрашивает крахмал в синий цвет; раствор йода в хлороформе окрашен в фиолетовый цвет.
Сильные окислители переводят йодиды в бесцветные гипойоди- ты (IO) или йодаты (IO3-), поэтому выбор окислителя и его концентрация имеют большое значение, ГФ рекомендует использовать для окисления йодидов растворы железа (III) хлорида или натрия нитрита:
В качестве окислителя ГФ предлагает также применять кислоту серную концентрированную, при действии которой на йодиды яри нагревании выделяются фиолетовые пары йода.
С раствором серебра нитрата в присутствии кислоты азотной йодиды образуют желтый творожистый осадок, нерастворимый в избытке аммиака:
Калий. Соли калия с раствором кислоты виннокаменной образуют белый кристаллический осадок кислой соли:
Осадок нерастворим в кислоте уксусной. К реакционной смеси добавляют натрия ацетат:
Образованию осадка способствуют добавление 95% спирта и встряхивание пробирки.
Осадок растворим в минеральных кислотах и растворах едких щелочей.
С раствором гексанитрокобальтата (III) натрия соли калия образуют желтый кристаллический осадок гексанитрокобальтата (III) калия, натрия, нерастворимый в кислоте уксусной, растворимый в минеральных кислотах:
В сильнокислой среде образуется нестойкая кислота гексанитрокобальтовая разлагающаяся в момент выделения. В щелочной среде образуется бурый осадок
Поскольку с данным реактивом образуют осадок и ионы аммония, соль калия предварительно (перед проведением реакции) прокаливают для удаления солей аммония.
Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет, а при рассматривании через синее стекло пламя приобретает пурпурно-красный цвет.
Кальций. Растворы солей кальция с оксалат-ионом образуют белый осадок, нерастворимый в кислоте уксусной, растворимый в разведенных минеральных кислотах:
Соль кальция, смоченная кислотой хлороводородной, окрашивает бесцветное пламя горелки в кирпично-красный цвет.
Карбонаты и гидрокарбонаты. При действии на карбонаты и гидрокарбонаты разведенных кислот появляются пузырьки диоксида углерода вследствие разложения выделяющейся нестойкой кислоты угольной:
При пропускании выделяющегося диоксида углерода через известковую воду образуется осадок кальция карбоната:
Отличить карбонаты от гидрокарбонатов можно по реакции среды с использованием индикатора — фенолфталеина. Карбонаты и гидрокарбонаты в растворе подвергаются гидролизу:
Карбонаты имеют сильно щелочную реакцию среды, в отличие от гидрокарбонатов, в которых происходит, помимо гидролиза, и диссоциация НСО3-иона:
В связи с этим реакция среды растворов гидрокарбонатов становится слабощелочной.
Таким образом, растворы карбонатов окрашивают фенолфталеин в розовый цвет, а растворы гидрокарбонатов не окрашивают его.
С насыщенным раствором магния сульфата растворы карбонатов образуют белый осадок:
Растворы гидрокарбонатов образуют такой же осадок, но при кипячении смеси (из-за перехода гидрокарбоната в карбонат):
Магний. Соли магния образуют е раствором натрия фосфата в присутствии аммония хлорида белый кристаллический осадок магний-аммоний фосфата, растворимый в кислоте уксусной:
Для предупреждения образования осадка магния гидроксида к реакционной смеси добавляют аммония хлорид, избытка которого, однако, следует избегать вследствие образования растворимых комплексных ионов [МgCl3] – , [МgCl4] 2-
Мышьяк. Мышьяк в ЛС присутствует в виде соединений, в которых его степень окисления равна +3 и +5, поэтому в ГФ приводятся реакции на арсениты (AsO3 3- ) и арсенаты (AsO4 3- ).
В среде кислоты хлороводородной арсениты и арсенаты образуют желтые осадки с сульфид-ионом, нерастворимые в концентрированной кислоте хлороводородной, но образующие растворимые комплексы с раствором аммиака:
С раствором серебра нитрата арсениты образуют желтый осадок серебра арсенита, растворимый как в кислоте азотной, так и в растворе аммиака;
Арсенаты с раствором серебра нитрата образуют коричневый осадок серебра арсената Аg3АgО4, также растворимый в кислоте азотной и растворе аммиака с образованием в последнем случае комплекса | Ag(NH3)2 |AsО4.
С ионами магния и аммония в присутствии аммония хлорида арсенаты образуют белый кристаллический осадок, растворимый в разведенной кислоте хлороводородной. Эта реакция позволяет отличить арсенаты от арсенитов:
Натрий. Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет. Соли натрия образуют желтый кристаллический осадок с цинка уранилацетатом. Осадок нерастворим в кислоте уксусной:
Нитраты. Обшей реакцией на нитраты и нитриты является реакция с дифениламином, основанная на окислении этого реактива (в присутствии нитратов или нитритов) в среде концентрированной кислоты серной до дифенилдифенохинондиимина гидросульфата, окрашенного в синий цвет. Раствор дифениламина готовится на концентрированной Н2SО4:
Нитраты можно открыть, используя реакцию с концентрированной H2SO4 и металлической медью по выделению бурых паров азота диоксида:
В отличие от нитритов, обладающих еще и восстановительными свойствами, нитраты не обесцвечивают раствор калия перманганата.
Нитриты. Нитриты, как и нитраты, можно идентифицировать с помощью дифениламина в присутствии кислоты серной концентрированной (см. Нитраты).
Нитриты являются солями неустойчивой кислоты азотистой. При выделении последней из ее солей она разлагается с выделением характерных газообразных продуктов:
Нитриты при реакции с антипирином в кислой среде образуют продукт замещения – нитрозоантипирин зеленого цвета (химизм – см. тему 12).
В отличие от нитратов, нитриты обесцвечивают раствор калия перманганата:
Ртуть (II). При действии щелочей на водные растворы солей ртути (II) образуется желтый осадок ртути оксида (II):
Ион Hg 2+ способен образовывать комплексные соли. При действии калия йодида на раствор ртути (II) хлорида образуется красный осадок ртути (II) йодида, растворимый в избытке реактива с образованием бесцветного раствора калия тетрайодидмеркурата:
Соли ртути (II) осаждаются сульфид-ионом из водных растворов в виде осадка черного цвета, нерастворимого в кислоте азотной:
Салицилаты. Салицилаты, обладающие кислотными свойствами, обусловленными наличием карбоксильной группы и фенольного гидроксила, образуют с железа (III) хлоридом в нейтральной среде соли, окрашенные в красно-фиолетовый или сине-фиолетовый цвет. Состав и соответственно цвет соли зависят от соотношения количества реактива и салицилат-иона (различная степень кислотности карбоксила и фенольного гидроксила). Минеральные кислоты вытесняют кислоту’ салициловую из солей с ионом железа (III), окраска исчезает, выпадает белый осадок кислоты салициловой (химизм — см. тему 6).
Сульфаты, Сульфаты с растворимыми солями бария дают белый осадок, нерастворимый в кислотах и щелочах:
Сульфиты. Кислота сернистая, являясь неустойчивой, при разложении выделяет сернистый газ, имеющий резкий характерный запах. Это свойство кислоты сернистой используется для обнаружения ее солей – сульфитов, из которых кислоту вытесняют разведенной кислотой хлороводородной:
С ионами бария сульфиты образуют белый осадок, который, в отличие от сульфата бария, растворим в разведенной кислоте хлороводородной:
Сульфиты, являясь восстановителями, обесцвечивают растворы брома и йода:
Тартраты. Тартраты с солями калия образуют белый кристаллический осадок (см. Калий).
При нагревании тартратов с концентрированной Н2SО4 и резорцином появляется вишнево-красное окрашивание вследствие образования легко окисляющегося продукта конденсации резорцина с карбонильным производным, получающимся в результате взаимодействия тартрата с концентрированной Н2SО4.
Фосфаты. Фосфат-ион осаждается из растворов серебра нитратом с образованием желтого осадка, растворимого в кислоте азотной и растворе аммиака:
Магнезиальная смесь осаждает из растворов фосфат-ион в виде осадка магний-аммоний фосфата (см. Магний).
Растворы фосфатов в разведенной кислоте азотной при взаимодействии с аммония молибдатом при нагревании окрашиваются в желтый цвет, затем образуется желтый кристаллический осадок аммония фосфомолибдата:
Хлориды. Растворы хлоридов с серебра нитратом образуют белый творожистый осадок, растворимый в аммиаке, аммония карбонате и нерастворимый в кислоте азотной:
Для солей органических оснований испытание растворимости образовавшегося осадка серебра хлорида проводят после отделения осадка и промывания его водой.
Цинк. Растворы солей цинка образуют с сульфид-ионом осадок цинка сульфида белого цвета, легко растворимый в разведенной кислоте хлороводородной и нерастворимый в кислоте уксусной:
С гексацианоферрат (П)-ионом соли цинка образуют белый студенистый осадок гексацианоферрат (II) цинка, калия, нерастворимый в разведенной кислоте хлороводородной:
Цитраты. Цитрат-ион образует с ионом кальция соль, растворимую в воде при комнатной температуре и выпадающую в осадок при кипячении:
Осадок растворим в кислоте хлороводородной.
При нагревании цитратов с ангидридом уксусным появляется красное окрашивание.
Источник