3. Лекарственные вещества, содержащие карбонильную группу (альдегидную, кетонную)
Альдегидной называется группа, в которой карбонил связан с атомом водорода и углеводородным радикалом (алифатическим или ароматическим).
Кетонной называется группа, в которой карбонил связан с двумя углеводородными радикалами (алифатическими или ароматическими).
К карбонильным соединениям относятся вещества, содержащие α-кетольную группировку, которая включает связанные между собой кетонную и спиртовую группы.
Альдегидную группу содержат формальдегид, глюкоза, хлоралгидрат, пиридоксальфосфат. Ряд лекарственных веществ образует альдегид при гидролитическом разложении (гексаметилентетрамин, никодин, анальгин, гексамидин).
Кетогруппа входит в структуру кортикостероидов (дезоксикортикостерон ацетат, кортизон ацетат, гидрокортизон, преднизолон, дексаметазон), гестагенных гормонов (прегнин, прогестерон); андрогенных гормонов (тестостерон пропионат, метилтестостерон, метандростенолон); бициклических терпенов (камфора, бромкамфора, кислота сульфокамфорная, сульфокамфокаин).
α-кетольную группировку содержат гормоны коркового слоя надпочечников и их полусинтетические аналоги.
Химические свойства соединений, содержащих альдегидную группу, определяются её строением: дипольным моментом карбонила, эффективным положительным зарядом на атоме углерода карбонила, поляризуемостью двойной связи(электронная плотность смещается к кислороду и на нем возникает дробный отрицательный заряд), что обуславливает высокую реакционную способность альдегидов.
Типы реакций, используемых для идентификации альдегидов:
ОВР: альдегиды проявляют сильные восстановительные свойства в щелочной среде, окисляются до соответствующих кислот.
Реакции присоединения: взаимодействие с бисульфитом натрия, фуксинсернистой кислотой. Кетоны этой реакции не дают.
Реакции замещения: на атоме углерода расположен центр электрофильности. Альдегиды и кетоны реагируют с нуклеофильными реагентами. В эту группу входят реакции конденсации альдегидов с фенолами, реакции конденсации альдегидов и кетонов с аминами и гидразинами.
Реакции полимеризации: эти реакции характерны для альдегидов, но в качестве анализа не используются.
В анализе ЛВ, содержащих альдегидную группу, наибольшее значение имеют реакции окисления, конденсации с фенолами, аминами и их производными.
Кетоны менее реакционноспособны. В отличие от альдегидов они окисляются только в жёстких условиях. Наибольшее практическое значение для ЛВ, содержащих кетогруппу, имеют реакции конденсации с аминами и их производными.
3.1. Реакция окисления
Лекарственные вещества, содержащие альдегидную группу, окисляются до карбоновых кислот с тем же числом атомов углерода, что и исходный альдегид.
Окисление происходит даже под действием слабых окислителей: йода, растворов комплексных соединений серебра, меди, ртути в щелочной среде при нагревании. Ионы серебра (I), меди (II) и ртути (II) восстанавливаются до свободных металлов или их оксидов, образуя окрашенные осадки, раствор йода обесцвечивается.
а) Реакция с аммиачным раствором нитрата серебра (реакция серебряного зеркала)
Формальдегид, окисляясь до аммонийной соли муравьиной кислоты, восстанавливает до металлического серебра, которое осаждается на стенках пробирки в виде «зеркала» или серого осадка.
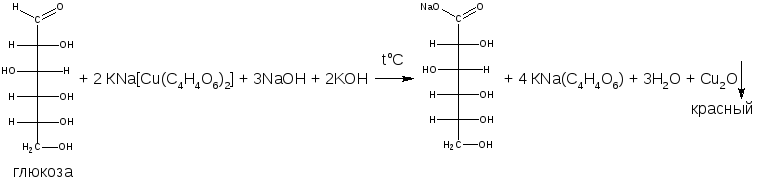
б) Реакция с реактивом Фелинга (комплексное соединение меди (II) с калий-натриевой солью винной кислоты). Альдегиды восстанавливают соединение меди (II) до оксида меди (I), образуется кирпично-красный осадок.
При сливании реактивов Феллинга 1 и 2 идут следующие реакции:
в) Реакция с реактивом Несслера (щелочной раствор тетрайодмеркурат (II) калия). Формальдегид восстанавливает ион до металлической ртути – осадок темно-серого цвета.
НСОН + K2[HgI4] + 3KOH → НСООК + Hg↓+ 4KI + 2H2O
Аналогичные реакции с перечисленными реактивами дают соединения с α-кетольной группировкой. Реакция протекает по схеме:
3.2. Реакции конденсации
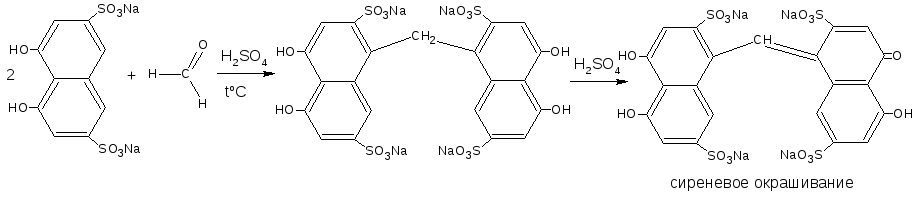
3.2.1. C фенолами (характерна для альдегидов). В присутствии концентрированной серной кислоты образуется бесцветный продукт конденсации, при последующем окислении которого получаются интенсивно окрашенные соединения хиноидной структуры. В качестве реактивов используется салициловая или хромотроповая кислоты.
Реакция используется для доказательства раствора формальдегида и веществ, гидролизующихся с его образованием (никодин, анальгин, гексаметилентетрамин, гексамидин).
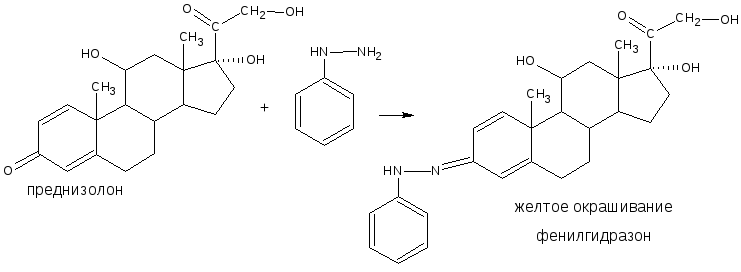
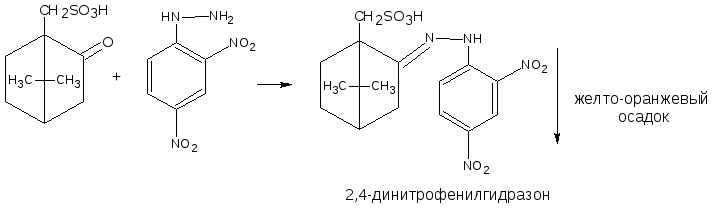
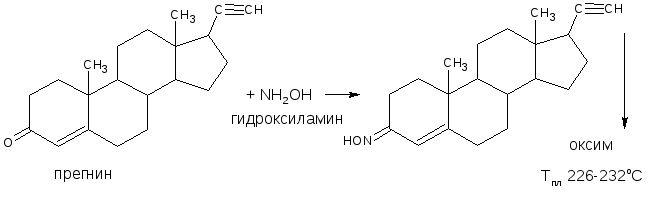
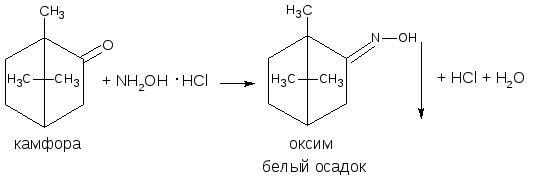
3.2.2. С аминами или их производными (характерны для ЛВ, содержащих как альдегидную, так и кетонную группы). В качестве реактивов используются соединения с первичной ароматической аминогруппой, производные гидразина – фенилгидразин, 2,4 – динитрофенилгидразин; гидроксиламин. При этом образуются соединения с азометиновой связью – основания Шиффа, гидразоны, оксимы, которые характеризуются определенной температурой плавления, разложения или окраской.
Реакция чаще используется для идентификации соединений с первичной ароматической аминогруппой (фенилгидразин).
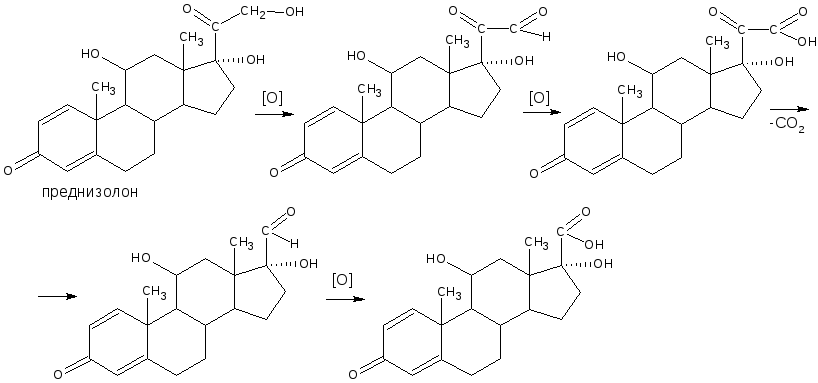
Реакция с фенилгидразином используется также для идентификации кортизона ацетата, преднизона, пиридоксальфосфата.
Реакция рекомендуется для подтверждения подлинности прогестерона, метандростенолона, кислоты сульфокамфорной.
Реакция является фармакопейной для прегнина, метилтестостерона, тестостерона пропионата.
3.3. Реакции присоединения
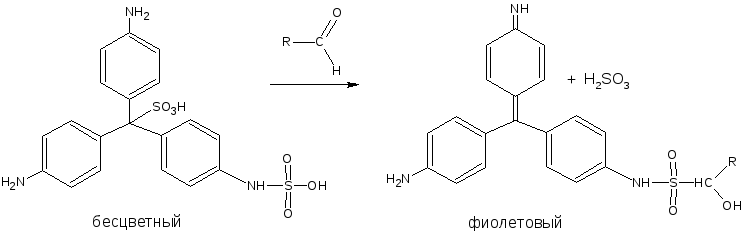
К этой группе относится реакция с фуксинсернистой кислотой. Эта кислота бесцветна, но при добавлении вещества с альдегидной группой образуется хиноидная структура красно-фиолетового цвета, при подкислении окраска исчезает. Исключение составляет формальдегид, так как в его присутствии окраска сохраняется:
3.4. Йодометрический метод обратного титрования (формальдегид, глюкоза, никодин).
Метод основан на свойстве альдегидов окисляться йодом в щелочной среде до кислоты. Йод взаимодействует с натрия гидроксидом с образованием натрия гипойодида, являющегося сильным окислителем.
I2 + 2NaOH → NaIO + NaI + H2O
Гипойодид натрия окисляет альдегид до кислоты.
HCOH + NaIO → HCOONa + NaI + H2O
Затем прибавляют избыток кислоты серной для выделения из непрореагировавшего гипойодида натрия йода, который оттитровывают раствором натрия тиосульфата.
HCOH + I2 + 3NaOH → HCOONa + 2NaI + 2H2O
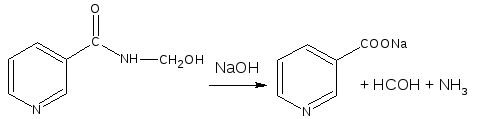
Никодин предварительно подвергают гидролизу и образующийся формальдегид определяют йодометрическим методом.
3.5. Оксимный метод
Используется в двух вариантах. Метод основан на свойстве кетонов образовывать с гидроксиламина гидрохлоридом оксим с выделением эквивалентного количества кислоты хлористоводородной. Дальнейшее определение проводят по кислоте алкалиметрическим методом (косвенное определение) или по оксиму, осадок которого отфильтровывают, промывают, высушивают до постоянной массы и взвешивают (гравиметрия).
HCl + NaOH → NaCl + H2O
3.6. Фотоколориметрия и спектрофотометрия
Для получения окрашенных соединений используют реакцию конденсации с фенолами, 2,4-динитрофенилгидразином.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
Альдегиды. Фармацевтический анализ альдегидов
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Органические лекарственные вещества, содержащие альдегидную группу, или их функциональные производные очень разнообразны по химической структуре и применению. Свойства лекарств, относящихся к алифатическим альдегидам и их производным, представлены в табл. 10.
Структура альдегидной группы (дипольный момент карбонила, частично положительный заряд на атоме углерода, поляризуемость двойной связи) обусловливает высокую реакционную способность веществ, содержащих эту функциональную группу:
Наиболее характерны для них реакции окисления и нуклеофильного присоединения.
Реакции окисления
Для альдегидов характерно окисление слабыми окислителями в щелочной среде (реакция ускоряется при нагревании).
Реакция «серебряного зеркала». При действии на альдегиды аммиачного раствора серебра нитрата (реактив Толленса) на стенках пробирки выделяется тонкий слой «серебряного зеркала» или выпадает серый осадок:
Реакция с реактивом Фелинга. Реактив Фелинга состоит из 2 растворов. Раствор № 1 представляет собой водный раствор меди сульфата, подкисленный малым количество кислоты серной. Раствор № 2 — это щелочной раствор калия-натрия тартрата. Реактивом служит смесь равных объемов обоих растворов. При взаимодействии альдегидов с реактивом Фелинга образуется кирпично-красный осадок меди (I) оксида:
Реакция с реактивом Несслера. Реактив является щелочным раствором калия тетрайодмеркурата. При взаимодействии с ним альдегиды дают осадок металлической ртути серого или чёрного цвета:
Следует отметить, что реакция с реактивом Несслера является более чувствительной, поэтому она применяется главным образом для обнаружения примесей альдегидов в других лекарственных средствах.
Нуклеофильное присоединение
Присоединение аминов. Из реакций присоединения наибольший интерес представляет присоединение аминов и их производных. В качестве реагентов применяют гидроксиламин, фенилгидразин, семикарбазид. При взаимодействии с альдегидами получают, соответствующие азометины (основания Шиффа): оксимы, фенилгидразоны, семикарбазоны:
Оксимы, гидразоны и семикарбазоны, как правило, являются нерастворимыми соединениями с характерными температурами плавления. Поэтому данные реакции применяют для качественного и количественного (гравиметрического) определения альдегидов. Образование оксимов лежит в основе оксимного титрования, используемого для количественного определения лекарственных веществ. Выделяющаяся в результате реакции кислота хлороводородная оттитровывается стандартным раствором щелочи. Эти же реакции используют и в синтезе лекарственных веществ.
Присоединение воды. Альдегиды обратимо взаимодействуют с водой, образуя гидратные формы:
Иногда, при наличии некоторых атомов или функциональных групп, можно получить устойчивые соединения, например хлоралгидрат.
Присоединение натрия гидросульфита. Данную реакцию используют для получения лекарственных веществ с лучшей, чем у предшественников, растворимостью (например, стрептоцид растворимый, анальгин).
4) Присоединение спиртов. Альдегиды образованием полуацеталей и ацеталей:
присоединяют спирты с
В кислой среде полуацетали гидролизуются до исходных альдегидов и спиртов. Однако в умеренно щелочной среде они стабильны.
Полуацеталями являются некоторые лекарственные вещества (например, углеводы, гликозиды). Реакцию используют также в синтезе, в частности, для защиты карбонильной группы (в щелочной среде).
5) Полимеризация. В водных растворах при определённых условиях альдегиды, в том числе формальдегид, могут полимеризоваться:
Данное свойство лекарств группы альдегидов учитывают при их хранении, так как в результате полимеризации получаются вещества с иными физико-химическими, а также фармакологическими свойствами, чем исходные.
6) Конденсация с фенолами. Со многими веществами разнообразной структуры альдегиды реагируют с образованием окрашенных соединений. Наиболее распространёнными для дифференциации лекарственных веществ группы альдегидов являются реакции с фенолами, в результате которых образуются арилметановые красители с общей формулой:
Окраска этих красителей и чувствительность реакции зависят от структуры альдегида и реагента. Очень чувствительной и избирательной является реакция формальдегида с кислотой хромотроповой (1,8-диоксинафталин-3,6-дисульфоновой):
Данную реакцию можно использовать и для определения подлинности лекарственных веществ, образующих формальдегид при гидролитическом расщеплении (анальгин, дихлотиазид, гексаметилентетрамин и др.).
По реакции с наиболее активными альдегидами, например формальдегидом, определяют морфина гидрохлорид, кодеин, кислоту салициловую, кислоту ацетилсалициловую, сульфаниламиды, барбитураты.
Ароматические альдегиды — такие, как n-диметиламинобезальдегид и ванилин, дают характерно окрашенные соединения: атропина сульфат, ментол, камфора, платифиллия и др.
С помощью этой же реакции определяют примесь метанола (после его окисления до формальдегида) в лекарственных веществах, например в барбитал-натрии.
Количественное определение (йодометрия)
Определение основано на окислении альдегидной группы стандартным раствором йода в щелочной среде, где образуется гипойодит:
Образовавшийся гипойодит окисляет альдегиды в щелочной среде до солей соответствующих карбоновых кислот:
Затем в раствор прибавляют избыток кислоты серной, чтобы выделить йод из не вступившего в реакцию взаимодействия с альдегидом гипойодита:
Выделившийся йод оттитровывают стандартным раствором натрия тиосульфата.
Известны и другие методики количественного определения альдегидов, в основе которых лежат реакции окисления-восстановления.
АНАЛИЗ ИНДИВИДУАЛЬНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Раствор формальдегида
Данное ЛС является водным раствором формальдегида с содержанием действующего вещества 36,5-37,5%. В качестве стабилизатора добавляют спирт метиловый (до 1%).
1) Реакция «серебряного зеркала». Испытание проводят е реактивом Толленса (аммиачный раствор серебра нитрата)
2) Образование арилметанового красителя. Формальдегид вступает в реакцию конденсации и окисления с кислотой салициловой (фенолом) в среде кислоты серной концентрированной. В результате получается краситель красного цвета.
Чистота. Специфической примесью в препарате является кислота муравьиная. Предел её содержания определяют алкалиметрически.
Количественное определение. Содержание формальдегида в препарате определяют йодометрически.
В ЛС «Формидрон» (4% спирто-водный раствор формальдегида) количественное определение лекарственного вещества осуществляют сульфитным методом. К раствору препарата добавляют избыток натрия сульфита; в результате реакции образуется эквивалентное количество натрия гидроксида:
Выделившийся натрия гидроксид титруют стандартным раствором кислоты хлороводородной.
Хлоралгидрат
Хлоралгидрат – 2,2,2,-трихлорэтандиол-1,1 – является устойчивой гидратной формой трихлорацетальдегида благодаря наличию и молекуле атомов галогена. Так, дегидратировать хлоралгидрат можно уже только при действии кислоты серной концентрированной.
Подлинность.
Нагревание хлоралгидрата с раствором щелочи приводит к образованию хлороформа (обнаруживается по запаху) и натрия формиата:
2) Образование «серебряного зеркала» с полученным натрия формиатом.
Чистота, Специфической примесью в хлоралгидрате может быть хлоралалкоголят (полуацеталь). Обнаружение его проводят по образованию йодоформа из полученного после щелочного гидролиза препарата этанола:
Наличие йодоформа подтверждается характерным запахом и осадком жёлтого цвета.
Количественное определение. Хлоралгидрат количественно определяют обратным методом. Сначала на навеску хлоралгидрата действуют определённым объёмом титрованного раствора натрия гидроксида (химизм — см. Определение подлинности). Затем избыток натрия гидроксида оттитровывают стандартным раствором кислоты хлороводородной в присутствии фенолфталеина в качестве индикатора.
Кроме приведённой выше методики, известны и другие способы количественного определения хлоралгидрата. Так, хлоралгидрат, как и другие альдегиды, можно определять йодометрически в щелочной среде:
Выделившийся при этом йод оттитровывают стандартным раствором натрия тиосульфата.
Метенамин (Гексаметилентетрамин)
Гексаметилентетрамин впервые синтезирован А.М. Бутлеровым в 1860 г. при взаимодействии водных растворов формальдегида и аммиака. Как ЛС он стал применяться только спустя 35 лет.
Получение идёт в несколько стадий. Сначала образуется гекса- гидро-1,3,5-триазин, а затем — гексаметилентетрамин:
Гексаметилентетрамин по структуре сходен с адамантаном и его можно рассматривать как тетраазаэдамантан. Кристаллическая решетка гексаметилентетрамина напоминает таковую алмаза.
Гексаметилентетрамин подвергается гидролизу в кислой среде с образованием формальдегида и солей аммония; в щелочной среде он относительно устойчив.
Подлинность.
1) ИК-спектр (сравнение со спектром стандартного образца),
2) После гидролиза в среде кислоты серной разведённой при нагревании ощущается запах формальдегида:
При последующем добавлении избытка раствора натрия гидроксида и нагревании ощущается запах аммиака:
Чистота.
В гексаметилентетрамине недопустимы примеси солей аммония и параформа, что возможно при нарушении условий хранения препарата. Обе примеси открывают реактивом Несслера (после добавления реактива не должно появляться ни жёлтого окрашивания, ни осадка). Для этого к раствору препарата добавляют реактив и нагревают на водяной бане. В присутствии солей аммония возникнет жёлтое окрашивание:
Параформ при нагревании даёт формальдегид, который с реактивом Несслера образует металлическую ртуть:
Количественное определение. Химические свойства гексаметилентетрамина позволяют применить для количественного определения лекарственного вещества различные титриметрические методы: кислотно-основное, окислительно-восстановительное, осадительное титрование, метод Кьельдаля.
Кислотно-основное титрование:
Обратная алкалиметрия (после кислотного гидролиза). Навеску препарата нагревают с избытком титрованного раствора кислоты серной. При этом гексаметилентетрамин разлагается до аммония сульфата и формальдегида (химизм – см. Определение подлинности). Избыток кислоты серной отгитровывают стандартным раствором натрия гидроксида в присутствии метилового красного в качестве индикатора (фармакопейный метод).
Кислотно-основное титрование в водной среде. В водной среде гексаметилентетрамин титруют как однокиелотное основание стандартным раствором кислоты хлороводородной в присутствии смешанного индикатора (метиленовый синий и метиловый оранжевый):
Кислотно-основное титрование в неводной среде, В среде метанола гексаметилентетрамин титруют стандартным раствором кислоты хлорной. Конец титрования определяют потенциометрически (Британская фармакопея, 2001):
Окислительно-восстановительное титрование:
Йодометрия. Являясь азотистым основанием, гексаметилентетрамин взаимодействуйт с раствором йода (как общеалкалоидным осадительным реактивом) с образованием малорастворимою тетрайодида:
Йодхлорметрия. В результате реакции между гексаметилентетрамином и избытком титрованного раствора йодмонохлорида образуется осадок комплексного соединения:
После фильтрования к фильтрату добавляют избыток калия йодида и выделившийся йод титруют стандартным раствором натрия тиосульфата:
Осадительное титрование. Метод основан на способности гексаметилентетрамина образовывать нерастворимые комплексные соединения с солями тяжёлых металлов, в частности с серебра нитратом;
Избыток серебра нитрата титруют стандартным раствором аммония тиоцианата в присутствии железо-аммониевых квасцов в качестве индикатора.
Источник