Медицинские интернет-конференции
Языки
Лечебный патоморфоз аденокарциномы простаты.
Кирякевич Л.О
Научный руководитель: к.м.н., доцент Воронина Е.С
Лечебный патоморфоз аденокарциномы простаты
Рак простаты – одно из самых распространенных онкологических заболеваний среди мужского населения большинства развитых стран мира.
Лечебный патоморфоз — это типовые и стойкие изменения клинических и морфологических проявлений опухоли под воздействием лечения. Неоспоримым методом оценки степени развития лечебного патоморфоза после воздействия на ткань простаты является гистологическое и иммуногистохимическое исследование.
В настоящее время одними из наиболее частых методов лечения рака простаты являются сфокусированная ультразвуковая аблация (HiFu), максимальная андрогенная блокада (МАБ).
После HiFu терапии в гистологических препаратах преобладают склеротические изменения с фрагментами железистой ткани.
Иммуногистохимическое исследование после лечения показало снижение маркера AMACR (маркер злокачественной трансформации клеток), снижение PCNA (маркер пролиферации), небольшое увеличение экспрессии Bcl-2 (регулятор апоптоза), маркер рецепторов к андрогенам оставался не прежнем уровне.
МАБ проводится с помощью орхэктомии и химической кастрации.
При оценке лечебного патоморфоза после МАБ отмечаются следующие изменения: в цитоплазме дистрофические изменения; ядра мелкие, гиперхромные. Некоторые участки опухоли теряют свое ацинарное строение.
При ИГХ-исследовании отмечается заметное снижения экспрессии маркера пролиферации, снижение экспрессии АMACR и P-53 (маркер регуляции клеточного цикла).
Таким образом при оценке лечебного патоморфоза после Hi-Fu-терапии с использованием стандартной окраски эозином гематоксилином наблюдается выраженный положительный результат (3 степень лечебного паморфоза), что подтверждается ИГХ-исследованием.
Для оценки лечебного патоморфоза после МАБ необходимо ИГХ-исследование, так как стандартная окраска не позволяет достоверно оценить степень патоморфоза.
Источник
Аденокарцинома с лечебным патоморфозом
Рак простаты (РП) занимает второе место среди злокачественных новообразований у мужчин. В последние годы отмечается быстрый рост заболеваемости РП. В России в 2000 году состояло на учете у онкологов 37 442 больных РП, а в 2010 году – 107 942 пациента, прирост составил 155 % [1]. Несмотря на улучшение методов диагностики и внедрение ПСА-мониторинга, заболеваемость запущенными формами РП в России остается на высоком уровне. В последние десятилетия эффективность лечения онкологических больных по показателям длительной выживаемости и продолжительности жизни изменяется незначительно [2]. Лечебный патоморфоз — это типовые и стойкие изменения клинических и морфологических проявлений опухоли под воздействием лечения. Неоспоримым методом оценки степени развития лечебного патоморфоза после воздействия на ткань простаты является гистологическое и иммуногистохимическое исследование [3,4]. Однако для разных методов лечения рака простаты характерны свои особенности морфологических и иммуногистохимических изменений.
Цель: изучение степени выраженности патоморфоза аденокарциномы простаты через 3 месяца после максимальной андрогенной блокады (МАБ).
Материалы и методы
В данной работе мы изучали материал, полученный от 30 пациентов с диагнозом ацинарная аденокарцинома простаты до и после лечения МАБ. До лечения исследовали материал трансректальной биопсии простаты, после – материал трансуретральной резекции простаты. Признаки патоморфоза РП оценивали через 3 месяца после билатеральной орхэктомии или химической кастрации (20 пациентов – после билатеральной орхэктомии, 10 пациентов – после 3 месяцев непрерывного приема элегарда). Материал после фиксации, стандартной проводки и парафинизации окрашивали гематоксилином и эозином. Изучали морфологические изменения не только в аденокарциноме, но и в железах простаты. Иммуногистохимические реакции проводили на парафиновых срезах, используя стрептавидин-биотиновый метод. В качестве детекционной системы применяли систему LSAB2 System, HRP (K0675) фирмы Daco, в качестве хромогена – диаминобензидин (Daсo). В работе использовали следующие антитела: Monoclonal Mouse Anti-Human Androgen Receptor Clone AR 441-фирма Daco (разведение 1:50); P53 Mouse Monoclonal Antibody- фирма CELL MARQUE (разведение 1:100); Monoclonal Mouse Anti-Human Ki67 Antigen Clone MIB-1-фирма Daco (разведение 1:100); AMACR Rabbit Polyclonal Antibody RP 134 R -фирма Diagnoatic BioSystems (разведение 1: 50); Monoclonal Mouse anti Bcl-2 oncoprotein-фирма Daco (разведение 1:50). Результаты реакций цитоплазматических маркеров (AMACR, Вcl2) оценивали полуколичественным способом по балльной шкале от 0 до 3 с помощью светового бинокулярного микроскопа «MicrosMC100», учитывая выраженность реакции и ее локализацию: 0 – отсутствие экспрессии, 1 – слабая экспрессия, 2 – умеренная экспрессия, 3 – сильная экспрессия маркера. Результаты экспрессии с ядерными антигенами (Р53, Andr) оценивали, подсчитывая количество окрашенных ядер на 100 ядер в 5 полях зрения, выражая полученные результаты в процентах. Результаты реакций оценивали по системе подсчета histochemical score (Hs). Система подсчета включает в себя интенсивность иммуногистохимической окраски по 3-х балkьной шкале и долю (%) окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное окрашивание.
Формула подсчета следующая: histochemicalscore (Hs) = ∑ P (i) х i,
где i – интенсивность окрашивания, выраженная в баллах от 0 до 3. P (i) – процент клеток, окрашенных с разной интенсивностью. Для определения индекса пролиферации экспрессии ядерного маркера Ki67 выполняли подсчет количества окрашенных ядер клеток опухоли, учитывая процентное соотношение окрашенных/неокрашенных ядер клеток на 100 учтенных клеток в 10-ти репрезентативных полях зрения при увеличении х40. Статистический анализ проводили с использованием пакета программ статистической обработки результатов SSPS 13.0 for Windows, критерия Манна – Уитни.
Результаты исследования и их обсуждение
В биоптатах простаты, до лечения у всех 30 пациентов была диагностирована ацинарная форма аденокарциномы 3+4=7 или 4+4=8 балов по Глисону, занимающая в среднем 40–60 % биоптата. Кроме участков аденокарциномы, у всех пациентов диагностировались признаки доброкачественной гиперплазии простаты (смешанный вариант) с простатической интраэпителиальной неоплазией (ПИН) высокой степени. Через 3–3,5 месяца после лечения МАБ при морфологическом изучении материала с помощью обзорных методов окраски, у всех пациентов (как после билатеральной орхэктомии, так и химической кастрации) в аденокарциноме развивались следующие изменения: в цитоплазме опухолевых клеток – дистрофические изменения. Ядра становились более мелкими, гиперхромными, ядрышки не визуализировались. После лечения у 70 % пациентов увеличивалась градация по Глисону, так как на некоторых участках опухоль теряла свое ацинарное строение, начинали преобладать участки солидного строения из мелких опухолевых клеток. Описанные изменения, развивающиеся в простате в первые месяцы после МАБ, отмечают и другие авторы [5]. В строме простаты у 98 % пациентов появлялась очаговая лимфоцитарная инфильтрация и полнокровие сосудов. Морфологические изменения в простате у пациентов после билатеральной орхэктомии и химической кастрации были одинаковые.
По данным литературы [6], опухолевый маркер Ki-67 является одним из наиболее востребованных в онкологии для морфологического определения пролиферативной активности опухолевых клеток, степени злокачественности новообразования и решения вопроса о виде дополнительного консервативного лечения в адъювантном и/или неоадъювантном режимах. Для достоверной оценки данного маркера изучали его экспрессию как до, так и после МАБ. До лечения индекс пролиферации опухолевых клеток был во всех случаях на достаточно высоком уровне и колебался от 40 % до 89 % (медиана 60 %). После МАБ (как билатеральной орхэктомии, так и химической кастрации) показатели индекса пролиферации заметно снижались и находились в пределах от 0 % до 25 % (медиана15 %). Сравнивая показатели двух групп по критерию Манна – Уитни, мы получили существенные различия. Экспрессия данного маркера в ядрах эпителия желез простаты (доброкачественная гиперплазия простаты с ПИН высокой степени) также снижалась: до МАБ медиана – 40 %, после – 1,5 %, однако по критерию Манна – Уитни различия в данных выборах были не существенны.
Альфа-метилацил-КоА-рацемаза (AMACR) – специфичный высокоэффективный иммуногистохимический онкомаркер, позволяющий дифференцировать рак простаты от других патологических процессов, а также более точно определить стадию заболевания. Этот маркер считается позитивным в 80–100 % случаев малых очагов рака [7]. В нашем исследовании до лечения у 96 % пациентов в аденокарциноме простаты отмечали сильную (3 балла) экспрессию данного маркера в виде мелких зерен коричневого цвета в цитоплазме, у 4 % пациентов – умеренную. После лечения у 56,5 % пациентов экспрессия данного маркера была слабая (1 балл), у 37,5 % – умеренная (2 балла), и лишь у 6 % пациентов экспрессия оставалась на высоком уровне (3 балла). Сравнивая показатели двух групп по критерию Манна – Уитни, мы получили существенные различия в уровнях выборок. Экспрессия AMACR находилась в прямой корреляции с маркером пролиферации Ki-67. Экспрессия данного маркера в цитоплазме эпителия желез простаты (доброкачественная гиперплазия простаты с ПИН высокой степени) также снижалась, однако по критерию Манна – Уитни различия в выборах до и после лечения были не существенны. Стромальная экспрессия данного маркера была минимальна как до, так и после МАБ.
Р53 иммуногистохимический маркер, локализующийся в ядре клетки, является супрессором опухолевого роста. Он предотвращает вступление клетки с поврежденной ДНК в фазу цикла и индуцирует апоптоз. Мутация гена р53 ведет к потере контроля пролиферации клеток, угнетению апоптоза. Утрата функции этого гена может быть связана с высоким метастатическим потенциалом опухоли и развитием андрогеннезависимого РП. Величина экспрессии мутированного р53 при РП зависит от того, состоит ли она из гормонозависимых клеток или образована гормононезависимыми клетками [7]. Однако другие авторы считают, что взаимосвязь между экспрессией маркера p53 и прогнозом при РП требует дальнейшего изучения [8]. В нашем исследовании мы учитывали экспрессию данного маркера в ядрах эпителия желез и в элементах опухоли. У пациентов до лечения МАБ в аденокарциноме простаты экспрессия данного маркера колебалась в пределах Hs= от 200 до 70 (медиана 130). После МАБ показатели экспрессии снижались: медиана Hs=60, но интервал колебания экспрессии данного показателя составлял от Hs=15 до 250. Сравнивая показатели групп по критерию Манна – Уитни, мы получили, что различия в уровнях выборок были не существенными. В ядрах эпителия простатических желез экспрессия Р53 до МАБ составляла Hs= от 70 до 0 (медиана 50), после лечения МАБ Hs= от 20 до 0 (медиана 5). По критерию Манна – Уитни различия в уровнях выборок были не существенными.
Антиген Всl-2 экспрессируется в цитоплазме и на базальной мембране эпителия желез и является регулятором апоптоза. В андрогеннезависимом РП отмечается усиленная экспрессия гена Bcl-2, что является признаком гормоноустойчивости [9]. Ген Вс1-2 способствует опухолевой прогрессии, ингибируя апоптоз и тем самым повышая выживаемость опухолевых клеток [10]. В нашем исследовании экспрессия данного маркера в клетках аденокарциномы у пациентов до МАБ была умеренной (2 балла) и сильной (3 балла) во всех случаях. После лечения у 12 % пациентов экспрессия оставалась сильной, у 41 % пациентов отмечали умеренную экспрессию, у 35 % – слабую, и у 12 % экспрессия данного маркера в опухолевых клетках была отрицательной. Используя критерий Манна – Уитни, можно считать, что различия в уровнях выборок являются существенными. У 93 % пациентов после МАБ положительная экспрессия Вс1-2 в лимфоцитах в очагах лимфоцитарной инфильтрации в строме простаты. Экспрессия данного маркера в цитоплазме эпителия желез простаты (доброкачественная гиперплазия простаты с ПИН высокой степени) снижалась, но по критерию Манна – Уитни различия в выборах до и после лечения были не существенны.
Источник
Патоморфологическая оценка простаты после радикальной простатэктомии
Т.О. Лаптева
ФГБУ «Ростовский научно-исследовательский онкологический институт» MЗ РФ; Ростов-на-Дону, Россия
Одним из самых важных вопросов, стоящих перед урологами и патоморфологами, является определение прогноза после радикальной простатэктомии (РПЭ). Наиболее ценной информацией для ответа на этот вопрос являются результаты патоморфологического исследования препарата после РПЭ. Так, по данным Stamey с соавт. [1] рецидив рака предстательной железы (РПЖ) после РПЭ может быть предсказан с высокой степенью точности на основании результатов патоморфологического исследования. Для того, чтобы правильно сориентировать и провести вырезку препарата «предстательная железа», нужно знать топографическую анатомию и гистологическое строение органа.
Зональная анатомия предстательной железы
Предстательная железа (ПЖ) – это непарный железисто-мышечный орган, который окружает простатическую часть мочеиспускательного канала и располагается между сфинктером мочевого пузыря и мочеполовой диафрагмой, по форме напоминающий каштан: длиной – 4–4,5 см, шириной 2,5–3 см, толщиной 1,2–2 см, объёмом 20–25 см3. Со всех сторон ПЖ окружена соединительнотканной капсулой, которая является продолжением прямокишечной перегородки.
МcNеаl предложил различать периферическую, центральную и переходную зоны, а также передний сегмент и зону сфинктера мочевого пузыря. В широкой урологической практике пользуются упрощённой схемой зональности ПЖ, где выделяют центральную, периферическую, переходную зоны и фибромускулярную строму: периферическая зона занимает до 70% железистой части простаты, её латеральной и задней части, протоки открываются в дистальном уретральном сегменте.
Происходит из мочеполового синуса. Срединная борозда делит её на правую и левую стороны; центральная зона занимает до 20-25% железистой части простаты, имеет конусовидную форму, включает все основание ПЖ, спускается от шейки мочевого пузыря к семенному бугорку, охватывая при этом семявыносящие протоки. Протоки центральной зоны открываются поблизости от семенного бугорка; переходная зона занимает до 5-10% железистой части ПЖ, располагается по бокам от простатической части уретры на уровне семенного бугорка.
Происходит из мочеполового синуса. Так же различают периуретральные железы и переднюю фибромускулярную строму («капсула») (рис. 1). Периферическая и центральная зоны имеют чёткие различия в строении стромы, протоков, что обусловлено различным эмбриогенезом и демонстрирует различия в их функциях. Переходная зона мало отличима от периферической, а с возрастом и при патологии различия вообще стираются.
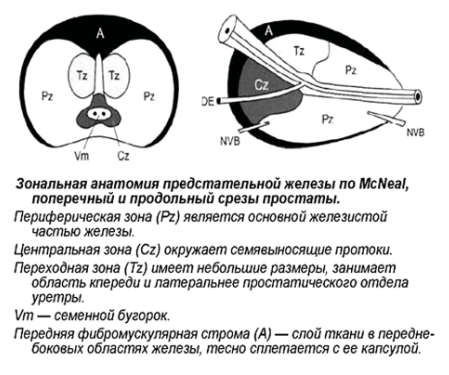
Рисунок 1. Соотношение доли позадилонной РПЭ к роботической РПЭ в США
Рак предстательной железы развивается с различной частотой в каждой зоне, и эта частота не пропорциональна массе железистой ткани в ней. Периферическая зона предстательной железы пальпируется через прямую кишку, она окружает центральную зону, в ней возникает около 70% аденокарцином ПЖ. Наиболее часто рак локализуется по задней и заднебоковой поверхностям ПЖ. Карциномы периферической зоны часто прорастают в перипростатические мягкие ткани по периневральным пространствам.
В центральной зоне возникаюттолько 5 – 10% от всех РПЖ. В переходной зоне самой частой патологией является доброкачественная гиперплазия предстательной железы (ДГПЖ), которая может приводить к значительному увеличению этой зоны, иногда превышающему по объёму остальные участки ПЖ. РПЖ в переходной зоне развивается реже, чем ДГПЖ, частота его составляет около 20%. В случае карцином переходной зоны экстрапростатическое распространение происходит по передней поверхности железы.
Опухоли из переходной зоны очень редко прорастают в периферическую зону. Периуретральные железы располагаются между простатической уретрой и проксимальным гладкомышечным сфинктером мочевого пузыря. Фибромускулярная строма занимает переднюю поверхность ПЖ и состоит преимущественно из мышечной ткани. Простатическая «капсула» не является истинной капсулой, а представляет собой периферическое уплотнение фибромускулярной стромы.
Правила вырезки препарата «предстательная железа» после РПЭ
Для оценки операционного материала после РПЭ необходима стандартная методика исследования макропрепарата, которая заключается в правильной ориентировке препарата – определения правой и левой долей, передней и задней поверхности, базальной и апикальной части железы. Для оценки краёв резекции и, возможных повреждений поверхности железы в ходе операции, рекомендуется окрашивание специальными чернилами поверхности макропрепарата ПЖ.
Препарат, фиксированный в 10% забуференном формалине в течение 24-36 часов, патолог разрезает по определенной схеме (рис. 2). Данная схема вырезки операционного материала позволяет более точно определить локализацию и объём опухолевых очагов. Макроскопически опухоль обычно представлена очагами неправильной формы диаметром около 5 мм, желтовато-белого цвета, плотной консистенции, что связано с диспластическими изменениями стромы.
Некоторые опухоли выглядят как желтоватые зернистые участки, что отличает их от нормальной губчатой ткани предстательной железы. РПЖ имеет тенденцию к мультилокулярному расположению и очень часто не выявляется макроскопически, что требует взятия большого количества материала для микроскопического исследования.
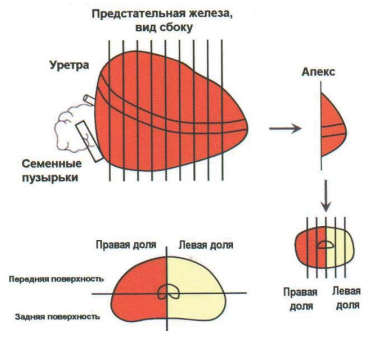
Рисунок 2. Схема вырезки предстательной железы [2]
РПЭ – гистологическое исследование
Патогистологический диагноз строится с учётом гистоархитектоники (структурно-тканевых) и цитологических признаков. Подавляющее большинство (до 95%) случаев РПЖ составляет обычная ацинарная аденокарцинома, и только небольшое количество представлено другими вариантами. Гистологическая картина обычной ацинарной карциномы вариабельна. Наиболее частый вариант – мелкие ацинарные структуры с признаками ядерной атипии.
В опухолевых ацинарных структурах отсутствует базальноклеточный слой, как правило, видны крупные чёткие ядрышки. Опухолевые ацинарные структуры могут быть разного размера, сливаться между собой, формировать криброзные структуры, тяжи и солидные поля. Подсчитано, что из 12 гистопатологических признаков, используемых при оценке степени аденокарциномы ПЖ, несомненную предсказательную ценность имеют 5 признаков: архитектоника расположения ацинусов, размеры клеточных ядер, форма ядра, наличие ядрышек, наличие фигур митоза.
Обычно для установления диагноза РПЖ бывает достаточно светооптического микроскопического исследования, прежде всего с определением гистологического варианта опухоли ПЖ. В 2016 году вышла в свет обновлённая классификация опухолей выделительной и мужской половой системы предстательной железы (WHO Classification of Tumors: Pathology and Genetics). В разделе новообразований предстательной железы наибольшие изменения коснулись группы эпителиальных опухолей.
В классификации Всемирной Организации Здравоохранения (ВОЗ) нашли отражение многие положения, принятые на консенсусе ISUP 2014 года. [3]. Согласно классификации ВОЗ (2016) варианты обычной аденокарциномы включают атрофический, псевдогиперпластический, микрокистозный, пенистоклеточный, муцинозный (коллоидный), перстневидно-клеточный, плеоморфный гигантоклеточный, саркоматоидный.
Неацинарный РПЖ составляет 5 – 10% случаев первичного РПЖ. В классификации ВОЗ (2016) выделены внутрипротоковая карцинома, протоковая карцинома, уротелиальная карцинома, плоскоклеточный и аденосквамозный рак, базальноклеточный рак, нейроэндокринные опухоли. В таблице 1 приведена актуальная гистологическая классификация опухолей предстательной железы (табл.1) [4].
Таблица 1. Классификация опухолей предстательной железы, ВОЗ (2016)
Нозологическая форма
ICD-O код
Эпителиальные опухоли
Из пенистых клеток
Простатическая интраэпителиальная неоплазия
Нейроэндокринные опухоли
Аденокарицнома с нейроэндокринной дифференцировкой
Высокодифференцированная нейроэндокринная опухоль
Мелкоклеточный нейроэндокринный рак
Крупноклеточный нейроэндокринный рак
Мезенхимальные опухоли
Стромальная опухоль с неопределенным потенциалом злокачественности
Воспалительная миофибробластическая опухоль
Недифференцированная плеоморфная саркома
Солитарная фиброзная опухоль
Злокачественная солитарная фиброзная опухоль
Гематолимфоидные опухоли
Опухоли неясного происхождения
Метастатические опухоли
Опухоли семенных пузырьков
В новой классификации пересмотрены подходы к определению степени дифференцировки и оценке индекса Глисона. По степени дифференцировки опухоли можно судить о месте возникновения аденокарциномы. Так, аденокарцинома, возникающая в переходной зоне ПЖ, обычно имеет низкую степень и клинически отличается меньшей агрессивностью, чем часто встречающаяся аденокарцинома периферической зоны ПЖ. Степень дифференцировки опухоли является одним из самых надёжных и полезных признаков определения стадии РПЖ.
Определение степени имеет прогностическую ценность, в частности, в отношении признаков распространения РПЖ за пределы ПЖ, инвазии семенных пузырьков, метастазов в лимфатические узлы или в кости. Фактически все временные показатели наступления рецидивов и выживаемости напрямую коррелируют со степенью, включая показатели выживаемости, продолжительность жизни без метастазов. Для оценки степени гистологической дифференцировки опухолевой ткани ПЖ используют систему Глисона (D.F. Gleason). Подсчёт по степени Gleason является прогностически наиболее точным относительно времени наступления рецидива после РПЭ.
Система градации по D.F. Gleason
В 1965 году Дональд Ф. Глисон предложил систему градирования РПЖ, основанную на гистологических критериях опухоли. Новым аспектом этой системы было определение степени дифференцировки рака не по наиболее злокачественному компоненту, а по сумме баллов распространённых структурных характеристик опухоли. В 1974 году система была несколько модифицирована. В 1993 году система градирования по Глисону была рекомендована конференцией ВОЗ и до сих пор остаётся одной из наиболее важных параметров для определения прогноза РПЖ. Система подвергалась минимальным изменениям, нашедшим отражение в 3 корректировках, принятых Международным Обществом Уропатологов в 2005, 2010 и 2014 годах (рис. 3).
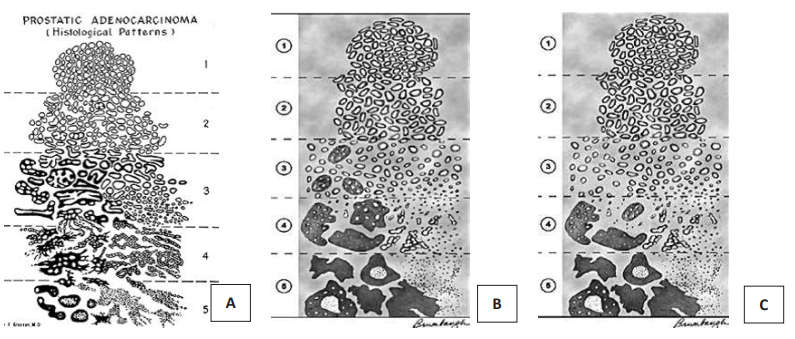
Рисунок 3. Схемы модификаций шкалы Глисона: А – оригинальная система Глисона;
В – схема градации с корректировкой в 2005 г. (ISUP); С – схема градации с корректировкой в 2010 г. (ISUP), утверждённая в 2012 г
Система градации по Глисону разработана для наиболее часто встречаемого морфологического варианта злокачественных опухолей предстательной железы – ацинарной аденокарциномы. Для других морфологических вариантов опухолей простаты система применима ограниченно, или не применима вообще. Система основана на степени железистой дифференцировки, ядерная атипия во внимание не принимается [5].
Система градации по Глисону определяет пять степеней с уменьшающейся дифференцировкой: от максимально приближенной к строению нормальной железы простаты до недифференцируемых структур. В различных отделах опухоли степень дифференцировки железистых структур может быть различной. Сумма Глисон складывается из градаций 2-х преобладающих структурных компонентов [4].
Каждая степень дифференцировки, из пяти возможных, описывается цифрой от 1 до 5. Правила составления суммы Глисон: – по операционному материалу – самый распространённый компонент опухоли + второй по распространённости (занимающий более 5% объёма опухоли); – по биопсийному материалу – самый распространённый компонент + самый злокачественный компонент без учёта его % доли.
При этом не следует указывать в биопсии сумму Глисона менее 6 баллов [1], так как отмечена низкая воспроизводимость результатов при последующем исследовании материала РПЭ, в виде повышения индекса Глисона. В отличие от предыдущего издания классификации ВОЗ (2004), описание градации по Глисону начинается со структур, соответствующих 3 баллам. Например, сумма Глисон 6 (3+3), 7 (3+4) или 7 (4+3), 8 (4+4), 8 (3+5) и т. д.
На практике значения Глисона 1 и 2 балла используются лишь в исключительных случаях. Опухоль с суммой Глисона 3-4 определена как «встречающаяся иногда при трансуретральной резекции и при мультифокальных опухолях в материале радикальной простатэктомии» [6]. При оценке аденокарциномы в материале РПЭ градируется по системе Глисон больший опухолевый узел, а мелкие фокусы высокодифференцированного рака не подлежат оценке.
Исключением является случай, когда в мелком фокусе определяется низкодифференцированный рак [6]. Неацинарный РПЖ в материале РПЭ составляет 5 – 10% случаев первичного РПЖ. Впервые в классификации ВОЗ (2016) выделена:
- внутрипротоковая карцинома, напоминающая высокую PIN (крибриформный вариант); она выявляется в 17% РПЭ и ассоциированна с низкодифференцированной ацинарной аденокарциномой, наличие очагов внутрипротоковой карциномы в материале биопсии является неблагоприятным прогностическим признаком [6]; при оценке индекса Глисон очаги внутрипротоковой карциномы не учитываются.
- дуктальная (протоковая) карцинома с вариантами крибриформным, папиллярным и солидным, встречается редко в 0,2 – 0,4% наблюдений, расположена центрально вокруг простатической уретры, а в сочетании с ацинарной аденокарциномой располагается в периферической зоне – в 3,2%, при оценке Глисон соответствует 4-5 баллам (сумма Глисон 8-9 баллов), часто встречаются комедонекрозы (5 баллов, сумма Глисон 10 баллов) [5].
- уротелиальный рак встречается в 0,7- 2,8% всех опухолей ПЖ, происходит из уротелия, выстилающего простатическую уретру и проксимальную часть простатических протоков. Вторичный уротелиальный рак наблюдается у пациентов с инвазивным раком мочевого пузыря, при котором в 45% случаев в процесс вовлекаются простатические железы. Уротелиальный рак не градируется по системе Глисона.
- высокодифференцированные нейроэндокринные первичные опухоли ПЖ встречаются редко, требуют иммуногистохимческого подтверждения; чаще определяется обычная ацинарная аденокарцинома с фокальной нейроэндокринной дифференцировкой (пока с неясным прогностическим значением) [2].
- мелкоклеточные нейроэндокринные раки ПЖ аналогичны мелкоклеточным опухолям легкого, обычно сочетаются с ацинарной аденокарциномой, нейроэндокринный компонент по Глисону не учитывается.
- плоскоклеточные опухоли очень редкие, встречаются после проведенного гормонального и лучевого лечения, имеют очень агрессивное течение.
Новая градирующая система аденокарциномы предстательной железы
Наряду с определением нозологического типа РПЖ и степени дифференцировки в классификации ВОЗ (2016) предусмотрены морфологические прогностические группы, принятые на согласительной конференции Международного общества уропатологов (ISUP), 2014 года [7] предусмотрено 5 прогностических градирующих групп (grading group), соответствующих определенной сумме по шкале Глисона (табл. 2).
ISUP рекомендует указывать прогностическую группу в гистологическом заключении после суммы баллов по Глисону, например, «7 баллов по Глисону (3+4), группа 2 (G2) или 7 баллов по Глисону (4+3), группа 3 (G3)». При этом в классификации сохранены прогностические группы ацинарной аденокарциномы, рассчитывающиеся на основании показателей TNM, уровня ПСА и индекса Глисон (табл. 3).
Таблица 2. Определение прогностической группы ацинарной аденокарицномы
| Прогностическая группа | Сумма баллов по Глисону |
| Группа 1, высокодифференцированные карциномы | Глисон ≤6 (только раздельно расположенные хорошо сформированные железы) |
| Группа 2, умереннодифференцированные карциномы | Глисон 7 (3 + 4) (преимущественно хорошо сформированные железы с небольшим компонентом плохо сформированных / рассыпающихся / крибриформных желез) |
| Группа 3, низко-умереннодифференцированные карциномы | Глисон 7 (4 + 3) (преимущественно плохо сформированные / рассыпающиеся/ крибриформные железы с небольшим компонентом хорошо сформированных желез) |
| Группа 4, низкодифференцированные карциномы | Глисон 8 (4+4), 8 (3+5), 8 (5+3) (только плохо сформированные/ рассыпающиеся/ крибриформные железы; тяжи опухоли, отдельные клетки, гнезда, трабекулы, структуры с очагами комедонекроза в сочетании с хорошо сформированными железами) |
| Группа 5, недифференцированные карциномы | Глисон 9-10 (плохо сформированные/ рассыпающиеся / крибриформные железы; тяжи опухоли, отдельные клетки, гнезда, трабекулы, структуры с очагами комедонекроза) |
Таблица 3. Клинические прогностические группы риска рака предстательной железы
Прогностическая группа
Категория Т
Категория N
Категория М
Уровень ПСА, нг/мл
Сумма Глисон, баллы
Классификация РПЖ по системе TNM (AjCC 8-е изд.)
Схема оценки первичной опухоли, согласно международной классификации РПЖ по системе TNM (AjCC 8-е изд.), которая была дополнена и пересмотрена в 2017 году:
- сТ0 (рТ0) – нет признаков первичной опухоли.
- сТ1 – клинически не определяемая (не пальпируемая и не визуализируемая) опухоль:
- сT1a – случайная гистологическая находка: опухоль обнаружена в ≤5 % образцов удаленной ткани (материала после ТУРП),
- сT1b – случайная гистологическая находка: опухоль обнаружена в >5 % образцов удаленной ткани (после ТУРП),
- сT1c – опухоль обнаружена при игольной биопсии простаты, не пальпируемая опухоль.
- сT2 (рТ2) – опухоль пальпируется и ограничена предстательной железой:
- сТ2а (рТ2) – опухоль занимает менее половины одной доли простаты,
- сT2b (рТ2) – опухоль занимает более половины одной доли простаты,
- сT2с (рТ2) – опухоль локализуется в обеих долях, но без выхода за капсулу железы.
- сT3 (рТ3) – опухоль распространяется за капсулу ПЖ, но без инвазии окружающих структур малого таза (не фиксирована при пальпации):
- сT3a (рТ3а) – распространение опухоли в парапростатическую клетчатку,
- сT3b (рТ3b) – определяется инвазия одного или обоих семенных пузырьков,
- сT4 (рТ4) – опухоль распространяется на структуры малого таза, кроме семенных пузырьков: стенку мочевого пузыря, наружный сфинктер уретры, прямую кишку, мышцы/стенки таза.
Классификация РПЖ TNM (AjCC 8-е изд.) не претерпела существенных изменений по отношению к классификации РПЖ TNM (AjCC 7-е изд.). Изменения коснулись патоморфологической стадии (р TNM): осталась только категория рТ0, категория рТ1 – не указывается, а в категории первичной опухоли рТ2, упразднены подкатегории рТ2а, рТ2b, рТ2с, они объединены в одну – рТ2.
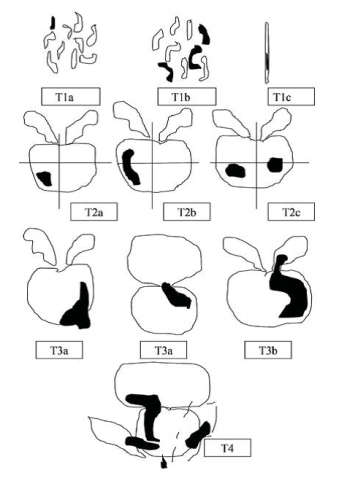
Рисунок 4. Схематическая классификация рака предстательной железы по системе TNM (2010)
Прогностические факторы при РПЭ
Ценным прогностическим фактором является наличие экстрапростатической инвазии с определением характера инвазии: фокальная или протяжённая. Опухолевые структуры могут определяться в парапростатической жировой клетчатке, вокруг структур сосудисто-нервного пучка, при выходе опухоли за пределы контура нормальной ткани простаты. Инвазия в семенные пузырьки диагностируется только в случае наличия опухолевого роста в мышечном слое свободной части семенных пузырьков и является плохим прогностическим признаком.
Инвазия в интрапростатическую часть семенных пузырьков не является истинной инвазией и имеет лучший прогноз [6]. Оценка статуса краёв резекции является обязательным критерием в оценке материала РПЭ. Положительным хирургическим краем резекции считается непосредственное наличие структур опухоли в маркированной красителем линии. В этом случае необходимо указать локализацию и протяжённость в мм положительного края, если позитивный край локализуется не в области верхушки и основания, указывается интра- или экстрапростаитческий край.
Это информация необходима для планирования тактики послеоперационного лечения [8]. Периневральная инвазия в ткани простаты после РПЭ не является значимым прогностическим фактором для ацинарной карциномы, несмотря на это рекомендуется указывать наличие периневральной инвазии в протоколе гистологического заключения. Периневральная инвазия в большинстве случаев обнаруживается вблизи капсулы железы, т. к. там располагается основная масса нервных стволиков.
Наличие периневральной инвазии в 50% случаев сопровождается капсулярной пенетрацией через инвазию и распространением по периневральному пространству. Риск прогрессирования после РПЭ у пациентов с наличием периневральной инвазии выше в 2 раза, чем у больных без неё [6]. Лимфоваскулярная инвазия — это стойкий прогностический фактор. Наличие лимфоваскулярная инвазии не влияет на стадию РПЖ, её рекомендовано подтверждать иммуногистохимическим методом.
При морфологической оценке ПЖ по материалу РПЭ после проведённой дооперационной терапии в гистологическом заключении отражаются изменения опухоли, объём опухолевой ткани, при возможности отображается сумма Глисона (она может повышаться). При выраженных изменениях после терапевтического и/или лучевого воздействия сумма Глисон не определяется [8].
Иммуногистохимическая диагностика РПЖ Раздел иммуногистохимической диагностики в материале ПЖ имеет достаточно ограниченный набор антител и включает в себя [6, 8]:
- дифференциальную диагностику с процессами, мимикрирующими мелкоацинарную АК, такими как постатрофическая гиперплазия, атипическая аденоматозная гиперплазия (ААГ), PIN, фокусы атипических желез, подозрительные на опухолевые, и предполагает использование антител к базальным клетками CK 34ßE12, p63, CK 5/6, AMACR (р504S). При наличии очагов мелкоацинарной аденокарциномы базальные клетки в ацинарных структурах отсутствуют и соответственно экспрессия с маркерами базальных клеток (CK 34ßE12, CK 5/6, p63) – негативная, но положительная реакция с онкомаркером AMACR (р504S). В случае доброкачественного процесса (постатрофическая гиперплазия, частичная атрофия желез) и предопухолевых процессов (атипическая аденоматозная гиперплазия (AAГ), PIN) при ИГХ реакциях отмечается позитивная экспрессия в базальных клетках, подозрительных ацинусов (цитоплазматическая и ядерная реакция) указанных маркеров (CK 34ßE12, CK 5/6, p63) и негативная экспрессия к AMACR (р504S);
- обязательное иммуногистохимическое подтверждение минимальной аденокарциномы, при наличии в биопсийном материале мелкого фокуса, занимающего менее 5% объема биоптата, протяженностью менее 1 мм, с применением антител CK 34ßE12, p63, AMACR (р504S);
- дифференциальную диагностику первичного уротелиального рака и уротелиального рака, происходящего из мочевого пузыря (CK7, CK20, p63, CKHW, PSMA);
- дифференциальную диагностику мелкоклеточного рака и низкодифференцированной АК с суммой Глисона (9-10) с лимфомой и метастическим мелкоклеточным раком другой локализации (Chromogranin A, Synaptophysin, CD56, TTF-1, PSA, p501s).
Применение иммуногистохимической диагностики ацинарной аденокарциномы при исследовании материала РПЭ имеет ограниченное значение, т. к. первичная диагностика опухоли была проведена в материале пункционной биопсии. Диагностическую значимость ИГХ исследование в материалах РПЭ имеет в случае:
- подозрения на наличие нейроэндокринного компонента в аденокарциноме (Chromogranin A, Synaptophysin);
- для определения лимфоваскулярной экстрапростатической инвазии (pan CK, CK 7, CD34);
- с целью оценки гормонального статуса в опухоли после проведённого гормонального лечения (Androgen Receptor).
Заключение
С учётом важности оценки значимых параметров в гистологическомзаключениипоматериалу РПЭ должны быть отображены: гистологический вариант опухоли, степень дифференцировки, сумма Глисона, прогностическая группа, распространённость опухоли по зонам (периферическая, центральная, переходная, апекс) и долям, объем (%) поражения опухолью, степень распространённости: врастает/прорастает псевдокапсулу железы, инвазия в семенные пузырьки, в простатический отдел уретры, в шейку мочевого пузыря, наличие периваскулярной, лимфоваскулярной инвазии, интра-, экстрапериневральной инвазии, состояние краёв резекции, оценка лимфатических узлов на наличие метастазов опухоли, стадия (рTNM), МКБ–О код (ICD-О code). Проводится оценка лечебного патоморфоза опухоли в случаях предоперационного лечения.
ЛИТЕРАТУРА
- Stamey TA, Yemoto CM, McNeal JE, Sigal BM, Johnstone IM. Prostate cancer is highly predictable: a prognostic equation based on all morphological variables in radical prostatectomy specimens. J Urol. 2000;163(4):1155-1160. PMID: 10737486
- Пушкарь Д.Ю., Говоров А.В., Сидоренков А.В., Прилепская Е.А., Ковылина М.В. Ранняя диагностика рака предстательной железы. Методические рекомендации №19. М.: ИД «АБВ-пресс»; 2015:8-9.
- Berney DM, Beltran L, Fisher G, North BV, Greenberg D, Møller H, Soosay G, Scardino P, Cuzick J. Validation of a contemporary prostate cancer grading system using prostate cancer death as outcome. Br J Cancer. 2016;114(10):1078- 1083. DOI: 10.1038/bjc.2016.86
- Moch H, Humphrey PA, Ulbright TM, Reuter VE, eds. WHO Classification of Tumours of the Urinary System and Male Genital Organs. vol. 8. 4th ed. WHO Press; 2016. ISBN-13 (Print Book) 978-92-832-2437-2.
- Франк Г.А., Андреева Ю.Ю., Москвина Л.В., ЕфремовГ.Д., Самойлова С.И. Новая классификация ВОЗ опухолей предстательной железы. Архив патологии. 2016;78(4):32-42. DOI: 10.17116/patol201678432-42
- Горбань Н.А., Кудайбергенова А.Г. Трепанобиопсия предстательной железы: взгляд морфолога. М.: ИД «АБВпресс»; 2017:101-117.
- Adam M, Hannah A, Budäus L, Steuber T, Salomon G, Michl U, Haese A, Fisch M, Wittmer C, Steurer S, Minner S, Heinzer H, Huland H, Graefen M, Sauter G, Schlomm T, Isbarn H. A tertiary Gleason pattern in the prostatectomy specimen and its association with adverse outcome after radical prostatectomy. J Urol. 2014;192(1):97-101. DOI: 10.1016/j. juro.2014.01.029
- Опухоли мочевыделительной системы и мужских половых органов. Морфологическая диагностика и генетика: Руководство для врачей. Под ред. Андреевой Ю.Ю.,Франка Г.А. М.: Практическая Медицина; 2012:110-167.
Источник



